
【题目】关键环节题组
I.以淀粉和油脂为原料,制备生活中某些物质。
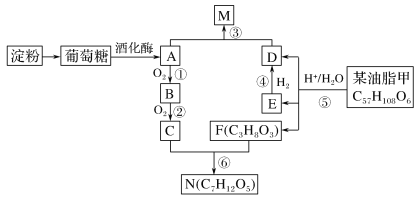
已知:反应⑤生成D、E、F的物质的量之比为2∶1∶1,E与等物质的量H2反应。
请回答:
(1) 写出N的所有可能的结构简式______________________________________
(2) 写出反应③(A+D→M)的化学方程式:_______________________________
II.酚醛树脂是一种合成塑料,线型酚醛树脂可通过如下路线合成:
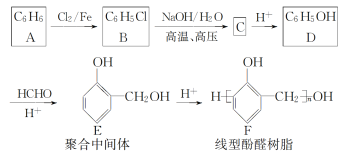
回答下列问题:
(1) B生成C的化学方程式为___________________________________,反应类型为_____。
(2) D生成E的反应类型是________,若D与HCHO按物质的量比1∶3发生类似反应,则生成另一种聚合中间体的结构简式为________________。
(3) E的同分异构体中,属于二元酚的共有________种,其中核磁共振氢谱有四组吸收峰,且峰面积比为3∶2∶2∶1的是______________(写出其一种的结构简式)。
(4) 尿素[CO(NH2)2]分子中氮原子上的氢原子可以像苯环上的氢原子那样与甲醛发生类似D→E→F的反应,则生成线型脲醛树脂的结构简式为________________________。
【答案】 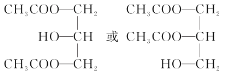 C17H35COOH+CH3CH2OH
C17H35COOH+CH3CH2OH![]() C17H35COOCH2CH3+H2O
C17H35COOCH2CH3+H2O  水解(取代) 加成反应
水解(取代) 加成反应 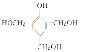 6
6 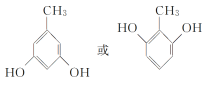
![]()
【解析】I.分析:葡萄糖在酒化酶的作用下生成乙醇CH3CH2OH,所以A的结构简式是CH3CH2OH,乙醇催化氧化生成乙醛,因此B的结构简式为CH3CHO,乙醛继续被氧化生成乙酸,因此C的结构简式为CH3COOH;油脂在酸性条件下水解生成F丙三醇(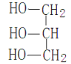 )和高级脂肪酸D和E,又因为E可以与氢气发生加成反应生成D,因此E中含有不饱和碳碳键,D属于饱和羧酸,且D和E具有相同的碳原子数,根据油脂甲的分子式C57H108O6可知D和E中碳原子数目为
)和高级脂肪酸D和E,又因为E可以与氢气发生加成反应生成D,因此E中含有不饱和碳碳键,D属于饱和羧酸,且D和E具有相同的碳原子数,根据油脂甲的分子式C57H108O6可知D和E中碳原子数目为![]() =18,甲的不饱和度为
=18,甲的不饱和度为![]() =4,因此甲中除了含3个酯基外,只含有一个碳碳双键,则E含有一个碳碳双键和一个羧基,碳原子数为18,所以E的化学式为C17H33COOH,D的化学式为C17H35COOH。
=4,因此甲中除了含3个酯基外,只含有一个碳碳双键,则E含有一个碳碳双键和一个羧基,碳原子数为18,所以E的化学式为C17H33COOH,D的化学式为C17H35COOH。
(1)乙酸和丙三醇反应生成N,又根据N的分子式可知N中含有2个酯基,因此N的结构简式为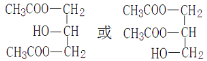 ;
;
(2)反应③为乙醇和饱和羧酸C17H35COOH反应生成酯M,化学反应方程式为C17H35COOH+CH3CH2OH![]() C17H35COOCH2CH3+H2O 。
C17H35COOCH2CH3+H2O 。
II.从A到D,分子中碳原子个数不变,根据E结构简式知,A为苯,结构简式为![]() ,苯发生取代反应生成氯苯,B为
,苯发生取代反应生成氯苯,B为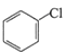 ,B发生取代反应生成C,C为
,B发生取代反应生成C,C为![]() ,C酸化得到D,D为
,C酸化得到D,D为![]() ,D和甲醛发生加成反应生成E,E在酸性条件下发生缩聚反应生成F。
,D和甲醛发生加成反应生成E,E在酸性条件下发生缩聚反应生成F。
(1)B为![]() ,根据结构简式知C的化学式为C6H5ONa,B生成C的化学方程式为:
,根据结构简式知C的化学式为C6H5ONa,B生成C的化学方程式为: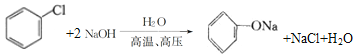 ,反应类型为:水解反应(或取代反应);
,反应类型为:水解反应(或取代反应);
因此,本题答案为: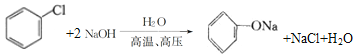 ;水解(取代);
;水解(取代);
(2)D生成E的反应类型是加成反应,若D与HCHO按物质的量1:3发生类似反应,则生成另一种聚合中间体的结构简式为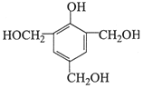 ;
;
(3)E的同分异构体中,属于二元酚,则含有两个酚羟基,同时还含有一个甲基,如果两个酚羟基相邻,则有2种同分异构体;如果酚羟基相间,则有3种同分异构体;如果酚羟基相对,则有1种同分异构体,所以一共有6种同分异构体;其中核磁共振氢谱有四组吸收峰,说明含有四种氢原子,峰面积比为3:2:2:1说明氢原子个数之比是3:2:2:1,则符合条件的结构简式为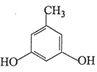 或
或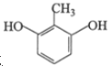 ,
,
(4)尿素[CO(NH2)2〕分子中氮原子上的氢原子可以像苯环上的氢原子那样与甲醛发生类似D→E→F的反应,则生成线型脉醛树脂的结构简式为![]() 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】如图为反应2H2(g)+O2(g)===2H2O(g)的能量变化示意图,下列说法错误的是

A.拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量
B.由H、O原子形成2molH2O(g),共放出1852kJ能量
C.1molH2(g)和1/2molO2(g)反应生成1molH2O(l),放出热量小于242kJ
D.2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表中“族”的说法正确的是( )
A. 元素周期表中共有七个主族、八个副族、一个0族
B. 同一主族元素原子最外层的电子数目不一定相同
C. 同一主族元素的化学性质相同
D. 族序数后标注A的元素是主族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,____与盐酸反应最慢。
Ⅱ. 利用如图装置可以验证非金属性的变化规律。
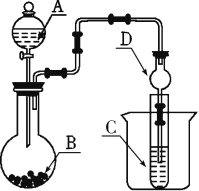
(2)仪器A的名称为_______,干燥管D的作用是_____。
(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为___、___、.____,装置C中的实验现象为有黄色沉淀生成,离子方程式为__________________。
(4)若要证明非金属性:S>C>Si,则A中加____,B中加Na2CO3,C中加_____,观察到C中溶液的现象为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是
A. 氯水、氨水均为电解质 B. Na2O2为碱性氧化物
C. NaOH、NH3·H2O都为可溶性碱 D. 蛋白质溶液、液氯均属于分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分条件已略去)。 A为海水中含量最高的盐类物质, C 为黄绿色气体, F为生活中常见的金属单质, I为红褐色沉淀。

(1)E的化学式为_____,I的名称为_______;
(2)写出D的电子式_______;
(3)写出反应①的化学方程式:______;写出反应⑤的离子方程式:_________。
(4)检验H溶液中金属阳离子的方法是_____________。
(5)保存G溶液时要加少量固体 F 的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
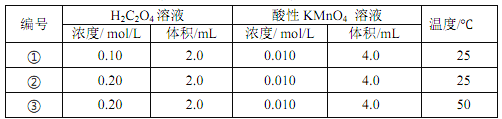
下列说法不正确的是
A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 若实验①测得 KMnO4溶液的褪色时间为 40 s, 则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol/L/s
C. 实验①和实验②是探究浓度对化学反应速率的影响, 实验②和③是探究温度对化学反应速率的影响
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的 Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产和生活中离不开金属材料。通常所说的“金属材料”,既包括纯金属,也包括各种合金。下列材料不属于合金的是
A. 青铜 B. 硬铝 C. 生铁 D. 磁铁矿
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com