
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于_____(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加______后加___________。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00molL﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为________________。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为______________________。
②含Cr3+废水需进一步处理,请你设计一个处理方案:________________________。
【答案】永久 石灰 纯碱 Mg(HCO3)2![]() Mg(OH)2↓+2CO2↑[或Mg(HCO3)2
Mg(OH)2↓+2CO2↑[或Mg(HCO3)2![]() MgCO3↓+CO2↑+H2O, MgCO3+H2O
MgCO3↓+CO2↑+H2O, MgCO3+H2O![]() Mg(OH)2↓+CO2↑] 除去溶解的CO2 33.6度 CN-+ClO-===CNO-+Cl- 调节废水pH,使其转化成Cr(OH)3沉淀除去(其他合理答案也可)
Mg(OH)2↓+CO2↑] 除去溶解的CO2 33.6度 CN-+ClO-===CNO-+Cl- 调节废水pH,使其转化成Cr(OH)3沉淀除去(其他合理答案也可)
【解析】
(1)因水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度,因除杂时不能引入新的杂质,过量的钙离子通过纯碱来除去,故先加石灰,后加纯碱,故答案为永久;石灰;纯碱;
(2)①由于自然界的水中大都溶有一定量的Mg(HCO3)2,在受热时生成Mg(OH)2,这种白色固体在容器内壁上积淀,即形成水垢,所以水垢形成的过程的方程式为Mg(HCO3)2=Mg(OH)2↓+2CO2↑,故答案为Mg(HCO3)2=Mg(OH)2↓+2CO2↑;
②预处理的方法是向水样中加入浓盐酸,盐酸与Mg(HCO3)2反应生成二氧化碳,CO2能溶于水,所以要加热煮沸除去,故答案为除去溶解的CO2;
③根据已知反应可知滴定前溶液为酒红色,滴定结束后为蓝色,所以溶液颜色变化为酒红色变为蓝色;用0.01000molL﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则n(M2+)=n(EDTA)=0.01000molL﹣1×15.00×10﹣3=1.5×10﹣4mol,则25ml水中m(CaO)=nM=56g/mol×1.5×10﹣4mol=8.2mg,所以1L水中m(CaO)=8.2mg×1000÷25=336mg,通常把1L水中含有10mg CaO称为1度,所以该地下水的硬度为336mL÷10mL=33.6度,故答案为33.6度;
(3)①步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;故答案为CN-+ClO-═CNO-+Cl-;
②Cr3+废水有毒,可使Cr3+生成沉淀过滤除去,故调节废水pH,使其转化成Cr(OH)3沉淀除去,故答案为调节废水pH,使其转化成Cr(OH)3沉淀除去。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )
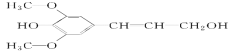
A.芥子醇的分子式是C11H12O4
B.芥子醇能发生水解反应
C.芥子醇分子中所有原子不可能在同一平面
D.1 mol芥子醇能与足量溴水反应消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:

(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2L体积固定的密闭容器中加入1molHI,发生反应:2HIH2(g)+I2(g) H>0,测得![]() 的物质的量随时间变化如表,下列说法正确的是
的物质的量随时间变化如表,下列说法正确的是
| 1 | 2 | 3 |
|
|
|
|
A.2min内的HI的分解速度为![]()
![]()
B.该温度下,平衡时HI的转化率为1![]()
C.该温度下的平衡常数为![]() ,温度升高10℃后平衡常数为
,温度升高10℃后平衡常数为![]() ,则K1>K2
,则K1>K2
D.达平衡后其他条件不变,压缩容器体积,平衡不移动,![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段使用催化剂。下列说法中不正确的是( )
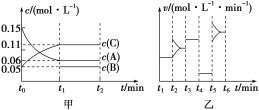
A.若t1=15 min,则用C的浓度变化表示在t0~t1时间段的平均反应速率为0.004 mol·L-1·min-1
B.t4~t5阶段改变的条件一定是减小压强
C.B的起始物质的量为0.02 mol
D.t5~t6阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,则该反应的热化学方程式为3A(g) B(g)+2C(g) ΔH=+100a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为![]() 时,在三个容积均为
时,在三个容积均为![]() 的恒容密闭容器中仅发生反应:
的恒容密闭容器中仅发生反应:![]() 正反应吸热
正反应吸热![]() 。实验测得:
。实验测得:![]() ,
,![]() ,
,![]() 、
、![]() 为速率常数,受温度影响。平衡常数
为速率常数,受温度影响。平衡常数![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数。下列说法不正确的是
物质的量分数。下列说法不正确的是![]()
![]()
容器 编号 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| |
Ⅰ |
| 0 | 0 |
|
Ⅱ |
|
|
| |
Ⅲ | 0 |
|
| |
A.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的小
比容器Ⅰ中的小
B.容器Ⅱ反应达平衡前,![]()
C.起始时容器Ⅰ中总压强为![]() ,则
,则![]() 时该反应的平衡常数
时该反应的平衡常数![]() kPa
kPa
D.当温度改变为![]() 时,若
时,若![]() 则
则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是

A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:![]() 。已知温度对
。已知温度对![]() 的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是
的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是
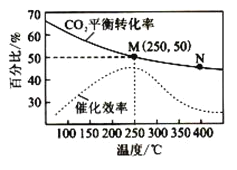
A.M点的正反应速率![]() 大于N点的逆反应速率v逆
大于N点的逆反应速率v逆
B.若投料比![]() ,则图中M点己烯的体积分数为
,则图中M点己烯的体积分数为![]()
C.![]() ,催化剂对
,催化剂对![]() 平衡转化率的影响最大
平衡转化率的影响最大
D.当温度高于![]() ,升高温度,平衡逆向移动导致催化剂的催化效率降低
,升高温度,平衡逆向移动导致催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是![]() 的43倍,其分子式为______。
的43倍,其分子式为______。
(2)![]() 烷烃E完全燃烧,消耗标准状况下的
烷烃E完全燃烧,消耗标准状况下的![]()
![]() ,其分子式为______。
,其分子式为______。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为______。
(4)某有机物的结构表达式为![]() ,其名称是______。
,其名称是______。
(5)萘的结构式为![]() ,其分子式为______。
,其分子式为______。
(6)立方烷![]() 的六氯代物有______种。
的六氯代物有______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com