
| A. | ③⑤④①② | B. | ③④②①⑤ | C. | ④①②⑤③ | D. | ③②④①⑤ |
科目:高中化学 来源: 题型:选择题
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
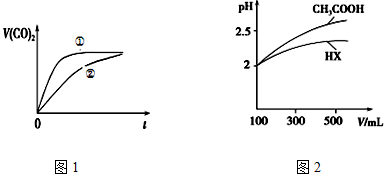
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的氨水溶液中c(OH-)=0.01 mol•L-1 | |
| B. | 常温下,将pH为12的氨水溶液加水稀释100倍,稀释后的溶液pH大于10 | |
| C. | 10 mL 1 mol•L-1的氨水溶液恰好与10 mL 1 mol•L-1的盐酸完全反应 | |
| D. | 在相同条件下,氨水溶液的导电性比NaOH溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 | |
| B. | 室温时,0.1 mol•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O?HCO3-+OH-向正反应方向移动,则溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下,0.0l mol/L醋酸溶液的pH=4 | |
| B. | 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 | |
| C. | 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 | |
| D. | 该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH>4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 | |
| B. | 把乙烯通入溴水中,溴水立即褪色,这是由于乙烯具有漂白性 | |
| C. | 煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com