
【题目】前四周期元素 A、B、C、D、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状 态;基态 B 原子 s 能级的电子总数比 p 能级的多 1;基态 C 原子和基态 E 原子中成对电子数均是未成对电 子数的 3 倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1) E 的元素名称为________。
(2)元素 A、B、C 中,电负性最大的是________(填元素符号,下同),元素 B、C、D 第一电离能由大到小的顺序为________。
(3)与同族其它元素 X 形成的 XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28'(填“>”“<”或“=”),请写出与BA3互为等电子体的一个离子________。
(4)BC3 离子中 B 原子轨道的杂化类型为________,BC3 离子的立体构型为________。
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图 所示)相似。若 DB 的晶胞参数为 a pm,则晶体的密度为________g·cm3(用NA表示阿伏加德罗常数)。
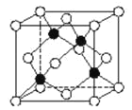
【答案】铬 O N>O>Al NH3分子间易形成氢键 < H3O+ sp2 平面三角形 ![]() ×1030。
×1030。
【解析】
前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态,则A为H元素;基态C原子中成对电子数是未成对电子数的3倍,为O元素;基态B原子s能级的电子总数比p能级的多1,则B为N元素;D形成简单离子的半径在同周期元素形成的简单离子中最小,原子序数大于C,为Al元素;基态E原子中成对电子数是未成对电子数的3倍,且原子序数大于D,则E为Cr元素,通过以上分析知,A、B、C、D、E分别是H、N、O、Al、Cr元素。
(1) E为Cr,E 的元素名称为铬,故答案为:铬;
(2)元素的非金属性越强,其电负性越大,非金属性O>N>H,则电负性O>N>H,所以电负性最大的是O元素;同一主族元素第一电离能随着原子序数增大而减小,则第一电离能B>Al,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能N>O,所以第一电离能N>O>Al,故答案为:O;N>O>Al;
(3)氨气分子之间存在氢键导致其易液化;氨气分子中N原子含有一个孤电子对和3个共价键,甲烷分子C原子形成4个共价键,孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以氨气分子键角小于甲烷分子中键角,即分子中键角<109°28′;等电子体满足两个条件:①原子个数相同,②价电子数相同,与NH3互为等电子体的一个离子为H3O+,故答案为:氨气分子间易形成氢键;<;H3O+;
(4)B、C分别为N、O,形成NO3-离子中N原子价层电子对个数3,且没有孤电子对,根据价层电子对互斥理论判断N原子杂化类型为sp2,该微粒空间构型平面三角形,故答案为:sp2;平面三角形;
(5)该晶胞中Al原子个数为4、N原子个数为4,该晶胞体积为(a×10-10cm)3,该晶体密度为![]() ,故答案为:
,故答案为:![]() 。
。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,在医药工业可用于头孢羟唑、血管扩张药环扁桃酸酯、滴眼药羟苄唑、匹莫林等的中间体,也可作防腐剂。实验室用如下原理制备:

合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:

步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。请回答下列问题:
(1)图中仪器C的名称是_________________,装置B的作用是_____________
(2)步骤一中合适的加热方式是_____________________。
(3)步骤二中用乙醚的目的是_____________________。
(4)步骤三中加入适量无水硫酸钠的目的是_____________________。
(5)该实验的产率为____________(保留三位有效数字)。
(6)扁桃酸在高端化学中也有很重要的作用,如以扁桃酸与正丁醇为原料,在催化剂的催化下可合成手性拆分剂扁桃酸正丁酯,试写出该反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是

A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯喹是合成一种抑制病毒药物的中间体,其合成路线如图:
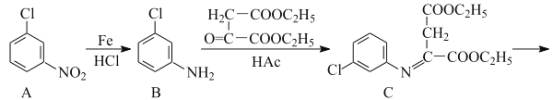
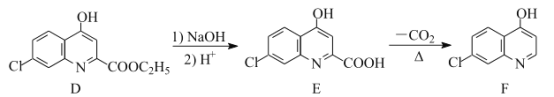
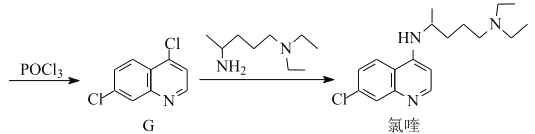
(1)D中含氧官能团的名称为___和___。
(2)A→B的反应类型为___。
(3)C→D的反应中有副产物X(X与D互为同分异构体)生成,写出X的结构简式:
___。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
①酸性条件下水解得到的两种有机产物,都能发生银镜反应,其中一种与FeCl3溶液发生显色反应;
②分子中有氰基(-CN),有一个手性碳原子,有4种不同化学环境的氢。
(5)已知:①![]() NH2易被氧化;
NH2易被氧化;
②酰氯(![]() Cl)的氯原子比氯代烃的更易被取代
Cl)的氯原子比氯代烃的更易被取代
③![]() RHC=N-CH2R’
RHC=N-CH2R’
写出以![]() 和
和![]() 为原料制备
为原料制备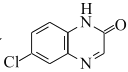 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿![]() 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() ,下列说法不正确的有
,下列说法不正确的有![]()
![]()

A. ![]() 分子为含极性键的非极性分子
分子为含极性键的非极性分子
B. ![]() 分子中含有3个
分子中含有3个![]() 键、一个
键、一个![]() 键,中心C原子采用
键,中心C原子采用![]() 杂化
杂化
C. ![]() 分子中所有原子的最外层电子都满足8电子稳定结构
分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法不正确的是( )
A.实验①中,若5min未测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速v(N)=1.0×10-3mol·L-1·min-1
B.实验②中,达到平衡时,Y的转化率为20%
C.实验③中,该反应的平衡常数K=1.0
D.实验④中,达到平衡时, b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体之间的反应有其独特的优点,对其研究具有重要意义。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。

在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g)![]() CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:_。
(4)计算图中A点的平衡常数Kp=__。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g)![]() N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
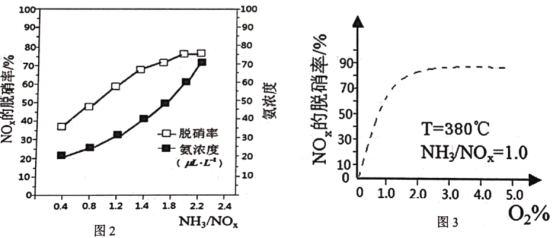 ①图2中,最佳氨氮比为2.0,理由是__。
①图2中,最佳氨氮比为2.0,理由是__。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)用蒸馏水稀释0.10mol/L的醋酸,则下列各式表示的数值随水量的增加而增大的是_____;
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图有关图象,说法正确的是( )
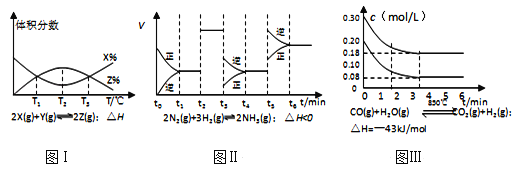
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com