
科目:高中化学 来源: 题型:
某混合气体是由HF、(HF)2、(HF)3三种气体组成,该混合气体的平均相对分子质量为38,则混合气体中HF的体积分数为: ( )
A.大于10% B.小于10% C.等于10% D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列物质的变化过程:H2→H2O;CO→CO2;C→CO2,说法不正确的是 ( )
A. 都能通过化合反应实现 B.都能通过置换反应实现
C.都能通过和单质反应实现 D.变化前后都有元素的化合价的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用含氧化铁75%(质量分数)的赤铁矿石和一氧化碳为原料炼铁(假设杂质不参加反应)。在炼铁过程中,为了使赤铁矿石充分反应,通入了过量的一氧化碳。这些过量的一氧化碳也可看成是“不参加反应的杂质”。若反应后排出的气体中一氧化碳的质量分数为10%。试计算:
(1)氧化铁(Fe2O3)的相对分子质量。
(2)该炼铁过程中所用原料赤铁矿石和一氧化碳的质量比。
(3)为了得到生铁,炼铁过程需要除去矿石中的部分杂质。如果不除去杂质,反应后所得到的产品中杂质的质量分数将会是多少?(结果可用分式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列几种化学符号,有关说法正确的是( )
①N ②Na+ ③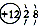 ④P2O5 ⑤KClO3.
④P2O5 ⑤KClO3.
A.表示物质组成的化学式有①④⑤ B.表示阳离子的有②③
C.④中数字“5”表示五氧化二磷中有5个氧原子 D.⑤中各元素的质量比为1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
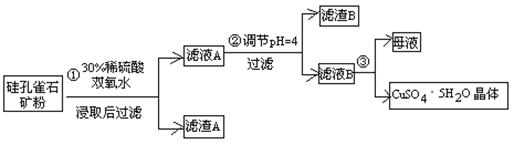
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
 Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
 Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)R2Cu
(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com