
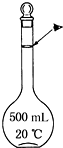
 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:分析 (1)根据配制500mL 0.5mol/L的NaCl溶液的步骤对各操作进行排序;
(2)①称量固体药品用托盘天平;②根据配制的溶液体积选用容量瓶的规格;③定容时先直接加水定容,最后需要改用胶头滴管定容;④溶解氯化钠的玻璃仪器上粘有溶质需洗涤;
(3)定容时俯视刻度线,导致所配溶液的液体偏小,浓度偏高;
(4)没有洗涤烧杯和玻璃棒,会导致配制的溶液中溶质的物质的量偏小;加水超过容量瓶刻度线,会导致配制的溶液浓度偏低.
解答 解:(1)配制500mL 0.5mol/L的NaCl溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确的配制顺序为:①②④③⑤,
故答案为:①②④③⑤;
(2)称量氯化钠固体需用托盘天平;
配制500mL溶液时需要使用500mL容量瓶,将溶解后的溶液转移到500mL容量瓶中;
定容的正确方法为:先直接向容量瓶中加蒸馏水至液面距刻度标线2-3cm处,然后改用胶头滴管进行定容;
溶解氯化钠的玻璃仪器烧杯和玻璃棒上粘有溶质需洗涤,否则配制的溶液浓度偏低;
故答案为:托盘天平;500mL容量瓶;胶头滴管;烧杯和玻璃棒;
(3)定容时俯视刻度线,导致所配溶液的液体偏小,浓度偏高,
故答案为:偏高;
(4)如果没有洗涤烧杯和玻璃棒,配制的溶液中溶质氯化钠的物质的量偏小,配制的溶液浓度偏低;
定容时如果加水超过容量瓶刻度线,会导致配制的溶液体积偏大,配制的溶液浓度偏低,
故答案为:偏低;偏低.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,注意掌握配制一定浓度的溶液方法,明确误差分析的方法与技巧.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些 昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质
COS(g)+H2(g) K=0.1反应前CO物质 的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:实验编号 | NaOH溶液的浓度/(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ①③④⑥ | D. | ②③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com