
”¾ĢāÄæ”æŌŚ200”ꏱ£¬½«a mol H2(g)ŗĶb mol I2(g)³äČėµ½Ģå»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗI2(g)+H2(g)2HI(g)”£
£Ø1£©·“Ó¦øÕæŖŹ¼Ź±£¬ÓÉÓŚc(H2)£½______£¬c(I2)£½______£¬¶ųc(HI)£½________£¬ĖłŅŌ»Æѧ·“Ó¦ĖŁĀŹ________×ī“ó¶ų________×īŠ”(ĪŖĮć)(Ģī”°vÕż”±»ņ”°vÄę”±)”£
£Ø2£©Ėę×Å·“Ó¦µÄ½ųŠŠ£¬·“Ó¦»ģŗĻĪļÖŠø÷×é·ÖÅØ¶ČµÄ±ä»ÆĒ÷ŹĘĪŖc(H2)________£¬c(I2)________£¬¶ųc(HI)________£¬“Ó¶ų»Æѧ·“Ó¦ĖŁĀŹvÕż________£¬¶ųvÄę________(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
£Ø3£©µ±·“Ó¦½ųŠŠµ½vÕżÓėvÄę________Ź±£¬“ĖæÉÄę·“Ó¦¾Ķ“ļµ½ĮĖ×ī“óĻŽ¶Č£¬Čō±£³ÖĶā½ēĢõ¼ž²»±äŹ±£¬»ģŗĻĪļÖŠø÷×é·ÖµÄĪļÖŹµÄĮ攢ĪļÖŹµÄĮæÅØ¶Č”¢ÖŹĮæ·ÖŹż”¢Ģå»ż·ÖŹż”¢·“Ó¦ĪļµÄ×Ŗ»ÆĀŹŗĶÉś³ÉĪļµÄ²śĀŹ¼°ĢåĻµµÄ×ÜŃ¹Ēæ(»ņø÷×é·ÖµÄ·ÖŃ¹)¶¼½«________”£
”¾“š°ø”æ
£Ø1£©![]() mol/L£»
mol/L£»![]() mol/L£»0£»¦Ķ£ØÕż£©£» ¦Ķ£ØÄę£©
mol/L£»0£»¦Ķ£ØÕż£©£» ¦Ķ£ØÄę£©
£Ø2£©¼õŠ”£»¼õŠ”£»Ōö“ó£»¼õŠ”£»Ōö“ó
£Ø3£©ĻąµČ£»±£³Ö²»±ä
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©øł¾Ż¹«Ź½c=![]() æÉŅŌ¼ĘĖć³öc£ØH2£©=
æÉŅŌ¼ĘĖć³öc£ØH2£©=![]() mol/L£¬c£ØI2£©=
mol/L£¬c£ØI2£©=![]() mol/L£¬c£ØHI£©=0£¬æŖŹ¼½×¶Ī·“Ó¦ÕżĻņ½ųŠŠ£¬¦Ķ£ØÕż£©×ī“󣬦Ķ£ØÄę£©=0£¬¹ŹĢī£ŗ
mol/L£¬c£ØHI£©=0£¬æŖŹ¼½×¶Ī·“Ó¦ÕżĻņ½ųŠŠ£¬¦Ķ£ØÕż£©×ī“󣬦Ķ£ØÄę£©=0£¬¹ŹĢī£ŗ![]() mol/L£»
mol/L£» ![]() mol/L£¬0£»¦Ķ£ØÕż£©£» ¦Ķ£ØÄę£©£»
mol/L£¬0£»¦Ķ£ØÕż£©£» ¦Ķ£ØÄę£©£»
£Ø2£©Ėę×Å·“Ó¦µÄ½ųŠŠ£¬·“Ó¦ĪļÅØ¶Č¼õŠ”£¬Éś³ÉĪļÅضČŌö“ó£¬Ö±µ½“ļĘ½ŗāדĢ¬£¬ÕżÄęĖŁĀŹĻąµČ£¬¹ŹĢī£ŗ¼õŠ””¢¼õŠ””¢Ōö“󔢼õŠ””¢Ōö“ó£»
£Ø3£©æÉÄę·“Ó¦¾Ķ“ļµ½µÄ×ī“óĻŽ¶ČŹĒ“ļĘ½ŗāדĢ¬£¬Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ¦Ķ£ØÕż£©Óė¦Ķ£ØÄę£©ĻąµČ£¬»ģŗĻĪļÖŠø÷×é·ÖµÄĪļÖŹµÄĮ攢ĪļÖŹµÄĮæÅØ¶Č”¢ÖŹĮæ·ÖŹż”¢Ģå»ż·ÖŹż”¢·“Ó¦ĪļµÄ×Ŗ»ÆĀŹŗĶÉś³ÉĪļµÄ²śĀŹ¼°ĢåĻµµÄ×ÜŃ¹Ēæ£Ø»ņø÷×é·ÖµÄ·ÖŃ¹£©¶¼½«±£³Ö²»±ä£¬¹ŹĢī£ŗĻąµČ£»±£³Ö²»±ä”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æH2C2O4ĪŖ¶žŌŖČõĖį”£20”ęÅäÖĘŅ»×éc(H2C2O4)+c(HC2O4ØC)+c(C2O42ØC)=0.100 mol”¤LØC1µÄH2C2O4ŗĶNaOH»ģŗĻČÜŅŗ£¬ČÜŅŗÖŠ²æ·ÖĪ¢Į£µÄĪļÖŹµÄĮæÅضČĖępHµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£Ņ»¶ØÕżČ·µÄŹĒ
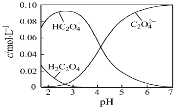
A£®pH=2.5µÄČÜŅŗÖŠ£ŗc(H2C2O4)+c(C2O42ØC)£¾c(HC2O4ØC)
B£®c(Na+)=0.100 mol”¤LØC1µÄČÜŅŗÖŠ£ŗc(H+)+c(H2C2O4)=c(OHØC)+c(C2O42ØC)
C£®c(HC2O4ØC)=c(C2O42ØC)µÄČÜŅŗÖŠ£ŗc(Na+)£¾0.100 mol”¤LØC1+c(HC2O4ØC)
D£®pH=7µÄČÜŅŗÖŠ£ŗc(Na+)<2c(C2O42ØC)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĦ¶ūŃĪŅ×[(NH4)2Fe(SO4)2]Ņ×ČÜÓŚĖ®£¬¾ßÓŠ»¹ŌŠŌ”£ŅŌĻĀŹĒĄūÓĆ·ĻĢśŠ¼”¢Ļ”ĮņĖįŗĶĮņĖįļ§ĪŖŌĮĻÖĘȔĦ¶ūŃĪµÄĮ÷³ĢĶ¼”£

»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŚ”°²½Öčl”±ÖŠ¼ÓNa2CO3ČÜŅŗŹĒĪŖĮĖĻ“µÓ³żČ„·ĻĢśŠ¼±ķĆęµÄÓĶĪŪ£¬¼ÓČȵÄÄæµÄŹĒ______£ØĄūÓĆ¼ņŅŖĪÄ×ÖŗĶ±ŲŅŖµÄĄė×Ó·½³ĢŹ½ĖµĆ÷£©£¬ÅäÖĘ100g10£„µÄNa2CO3ČÜŅŗŠčŅŖµÄŅĒĘ÷ÓŠŅ©³×”¢ĮæĶ²”¢ÉÕ±”¢²£Į§°ōŗĶ_______£»
£Ø2£©”°²½Öč2”±ÖŠĖłÓĆ·ĻĢśŠ¼±ŲŠė¹żĮ棬ŌŅņŹĒ______________£»
£Ø3£©”°²½Öč3”±¼ÓČė(NH4)2SO4¹ĢĢå³ä·Ö½Į°čČܽāŗó£¬ŅĄ“Ī½ųŠŠµÄŹµŃé²Ł×÷ŹĒ£ŗÕō·¢ÅØĖõ”¢______”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£»
£Ø4£©Ņ»°ć²ÉÓƵĪ¶Ø·Ø²ā¶ØĦ¶ūŃĪ²śĘ·ÖŠFe2£«µÄŗ¬Įæ£ŗ³ĘČ”4.0gĦ¶ūŃĪѳʷ£¬ČÜÓŚĖ®£¬¼ÓČėŹŹĮæĻ”ĮņĖį£¬ÓĆ0.2 mol/LKMnO4ČÜŅŗµĪ¶Ø£¬“ļµ½ÖÕµćŹ±£¬ĻūŗÄ10.00 mL KMnO4ČÜŅŗ”£
¢Ł µĪ¶Ø¹ż³ĢÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________£»
¢Ś ²śĘ·ÖŠFe2£«µÄÖŹĮæ·ÖŹżĪŖ_________£»
¢Ū µĪ¶Ø¹ż³ĢÖŠ£®×óŹÖæŲÖĘ________£¬ÓŅŹÖŅ”¶Æ׶ŠĪĘ棬ֱµ½_________Ź±Ķ£Ö¹µĪ¶Ø£¬¶ĮŹż”£“ĖŹ±Čōø©ŹÓ¶ĮŹż£®²ā¶Ø½į¹ū½«Ę«________£ØĢī”°øß”±»ņ”°µĶ”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ“×Ėį“ļµ½µēĄėĘ½ŗāŗó£¬øıäijĢõ¼žµēĄėĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A. ŹµĻÖøƱä»ÆµÄÖ»ÄÜŹĒÉżøßĪĀ¶Č
B. ČÜŅŗµÄµ¼µēÄÜĮ¦Ņ»¶Ø±äĒæ
C. ČÜŅŗµÄpHŅ»¶Ø¼õŠ”
D. ·¢ÉśµēĄėµÄ·Ö×Ó×ÜŹżŌö¶ą
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖŌŚ£¬ĪŅĆĒ°ŃĪŽĪŪČ¾£®ĪŽ¹«ŗ¦µÄŹ³Ę·½Š×öĀĢÉ«Ź³Ę·”£¶ų×ī³õ£¬×ؼŅ°ŃĀĢÉ«Ö²ĪļĶعż¹āŗĻ×÷ÓĆ×Ŗ»ÆµÄŹ³Ę·½Š×öĀĢÉ«Ź³Ę·£¬ŗ£ŃóĢį¹©µÄŹ³Ę·½Š×öĄ¶É«Ź³Ę·£¬ĶعżĪ¢ÉśĪļ·¢½ĶÖʵƵď³Ę·½Š×ö°×É«Ź³Ę·”£øł¾Ż×ī³õµÄĖµ·Ø£¬ĻĀĮŠŹōÓŚĀĢÉ«Ź³Ę·µÄŹĒ£Ø £©
A. “óĆ× B. ŗ£“ų C. Ź³“× D. Ź³ŃĪ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö¼Ó£¬K”¢L”¢M¾łŹĒÓÉÕāŠ©ŌŖĖŲ×é³ÉµÄ¶žŌŖ»ÆŗĻĪļ£¬¼×”¢ŅŅ·Ö±šŹĒŌŖĖŲX”¢YµÄµ„ÖŹ,¼×ŹĒ³£¼ūµÄ¹ĢĢ壬ŅŅŹĒ³£¼ūµÄĘųĢ唣KŹĒĪŽÉ«ĘųĢ壬ŹĒÖ÷ŅŖµÄ“óĘųĪŪČ¾ĪļÖ®Ņ»£¬0.05mol/L±ūČÜŅŗµÄpHĪŖl£¬ÉĻŹöĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©

A. Ō×Ó°ė¾¶£ŗW B. ŌŖĖŲµÄ·ĒČ«ŹōŠŌ£ŗZ>Y>X
C. »ÆŗĻĪļXYZÖŠÖ»ŗ¬¹²¼Ū¼ü D. K”¢L”¢MÖŠ·Šµć×īøߵďĒM
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠ£¬ŌŚæĘѧÉĻƻӊ“ķĪóµÄŹĒ
A. Īü“ų¹żĀĖ×ģµÄĻćŃĢ£¬¶ŌČĖĢåĪŽŗ¦
B. ±£»¤»·¾³¾ĶŹĒ±£»¤ČĖĄą×Ō¼ŗ
C. “æĢģČ»ĪļÖŹÅä³ÉµÄŅūĮĻ£¬²»ŗ¬ČĪŗĪ»ÆѧĪļÖŹ
D. Ė®æÉŅŌ±äĪŖÓĶ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·Ö×ÓŹ½ĪŖC5H7Br µÄÓŠ»śĪļ£¬²»æÉÄÜŹĒ
A. Ö»ŗ¬ÓŠ1øöĖ«¼üµÄÖ±Į“ÓŠ»śĪļ B. ŗ¬ÓŠ2øöĖ«¼üµÄÖ±Į“ÓŠ»śĪļ
C. ŗ¬ÓŠ1øöĖ«¼üµÄ»·×“ÓŠ»śĪļ D. ŗ¬ÓŠ1øöČž¼üµÄÖ±Į“ÓŠ»śĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ25”ꏱ²æ·ÖČõµē½āÖŹµÄµēĄėĘ½ŗā³£ŹżŹż¾ŻČēĻĀ±ķ£ŗ
»ÆѧŹ½ | CH3COOH | H2CO3 | HClO | |
Ę½ŗā³£Źż | Ka=1.8”Į10-5 | Ka1=4.3”Į10-7 | Ka2=5.6”Į10-11 | Ka=3.0”Į10-8 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1) ĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0£®1mol”¤LŅ»1µÄĖÄÖÖČÜŅŗ£ŗa£®CH3COONa b£®Na2CO3 c£®NaClO d£®NaHCO3£¬pHÓÉŠ”µ½“óµÄÅÅĮŠĖ³ŠņŹĒ___________ (ÓĆ×ÖÄø±ķŹ¾)
(2) ³£ĪĀĻĀ£¬0£®1mol”¤L”Ŗ1µÄCH3COOHČÜŅŗ¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠ£¬ĻĀĮŠ±ķ“ļŹ½µÄŹż¾Ż±ä“óµÄŹĒ_______ (ĢīŠņŗÅ)
A£®c£ØH+£© B£®c(H+)£Æc(CH3COOH)
C£®c(H+)”¤c(OH”Ŗ) D£®c(OH-)£Æc(H+)
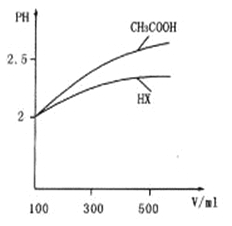
(3) Ģå»ż¾łĪŖl00mL pH=2µÄCH3COOHÓėŅ»ŌŖĖįHX£¬¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠpHÓėČÜŅŗĢå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ŌņHXµÄµēĄėĘ½ŗā³£Źż_______ (Ģī”°£¾”±”¢”°£¼”±»ņ”°=”±)CH3COOHµÄµēĄėĘ½ŗā³£Źż”£
(4) 25”ꏱ£¬ŌŚCH3COOHÓėCH3COONaµÄ»ģŗĻČÜŅŗÖŠ£¬Čō²āµĆpH=6£¬ŌņČÜŅŗÖŠ£ŗ
¢Ł c(CH3COO”Ŗ)”Ŗc(Na+)=_______ mol”¤L”Ŗ1(Ģī¾«Č·Öµ)
¢Ś c(CH3COO-)£Æc(CH3COOH)=_______ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com