
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法中,正确的是
( )
A.二氧化硅溶于水生成硅酸,所以二氧化硅属于酸性氧化物
B.将二氧化碳通入硅酸钠溶液中可以得到硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.水晶是比较纯净的二氧化硅,沙子的主要成分是硅酸盐
科目:高中化学 来源: 题型:
为了探究新制饱和氯水的组成和性质而进行了如下科学实验:先观察了氯水的外观性质以后,再用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。请回答下列问题:
(1)写出新制饱和氯水中含有氯元素物质的化学式:
__________________________________________。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:____________________。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
①__________________________________________。
②__________________________________________。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②________________,振荡试管。
[实验现象及结论]
①若________________,则证明溶液红色褪去的原因是①而不是②;
②若________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中充入1 mol A和b mol B气体,发生如下反应:A(g)+B(g)
 2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
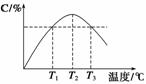
A.0~5 min,C物质的平均反应速率为0.04 mol·L-1·min-1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三个电解池,A池内盛有CuCl2溶液,纯铜片作阴极,B与C两池内均盛有AgNO3溶液,纯银丝作阴极。当B池中银丝质量增加0.108 g、C池中银丝质量增加0.216 g时,A池中铜片质量增加( )
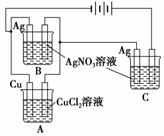
A.0.216 g B.0.108 g
C.0.064 g D.0.032 g
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
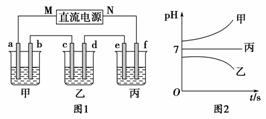
(1)M为直流电源的________极,b电极上发生的电极反应为__________________________________________________________。
(2)计算e电极上生成的气体在标准状况下的体积为________。
(3)写出乙烧杯中的总反应的离子方程式:__________________________________________________________。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
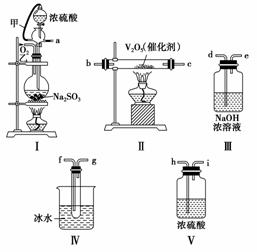
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国有丰富的锆英石资源,其主要成分是ZrSiO4,还含有Al2O3、SiO2、Fe2O3等杂质,生产锆的流程之一如下:
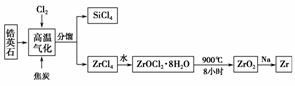
已知:锆(Zr)合金是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。
(1)上述流程中高温气化的反应是氧化还原反应(碳转化成CO),其中氧化剂是________,转移1.204×1024个电子时,生成SiCl4________g。
(2)写出ZrCl4与水反应的化学方程式:______________________,写出ZrOCl2·8H2O在900℃条件下分解的化学方程式:____________________________________。
3下列关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 。
A.1 nm=10-10 m
B.锆合金的硬度比纯锆要高,C.二氧化锆纳米陶瓷是新型无机非金属材料
4一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 填“正”或“负”极移动。电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)吸收液吸收SO2的过程中,pH随n(SO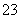 )∶n(HSO
)∶n(HSO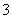 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:________________________________________________________________________。
(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:
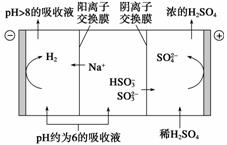
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生产、生活密切相关。下列说法正确的是( )
A.石英只能用于生产光导纤维
B.从海水中提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com