
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 催化剂 |
| 催化剂 |
| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
 ,故答案为:
,故答案为: ;
;

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
| A、加少量烧碱溶液 |
| B、加入浓度为0.001mol?L-1的HCl溶液 |
| C、加少量冰醋酸 |
| D、降低溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③④⑥ |
| C、①②③⑥ | D、①②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
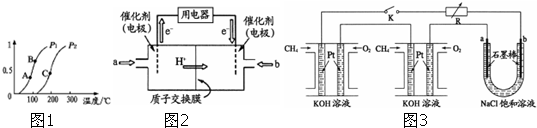
查看答案和解析>>
科目:高中化学 来源: 题型:
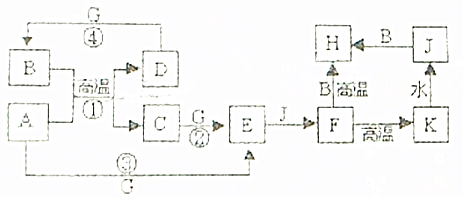
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离程度始终增大 | ||
B、
| ||
| C、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||
| D、当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、目前使用的元素周期表中,最长的周期含有36种元素 |
| B、周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C、非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
| D、IA族与VIIA族元素间可形成共价化合物或离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将城市的大型电镀工厂改建在农村,既促进农村经济发展又减轻城市用水污染 | ||||
| B、可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | ||||
| C、核裂变是一种化学变化 | ||||
D、核电站泄露的
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com