
【题目】某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
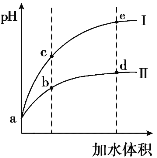
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中![]() 保持不变
保持不变
D.该温度下,b点Kw的数值比e点大
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
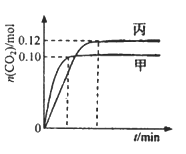
容器 | 温度/℃ | 起始物质的量浓度/mol·L-1 | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T1 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率大于40%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A. 反应结束后最终溶液呈碱性
B. 阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C. 电解过程中氯离子移向阳极
D. 试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加罗常数的值。下列说法正确的是( )
A. 标准状况下11.2 L ND3分子中所含中子数为5NA
B. 电解2 mol·L-1的NaCl溶液转移的电子数为2NA
C. 100 mL含Al3+为0.4NA的Al2(SO4)3溶液的物质的量浓度为2.0 mol·L-1
D. 常温常压下,7.8 g苯分子中含有的碳碳双键数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸)
B. 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷
C. CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子
D. 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论不正确的是
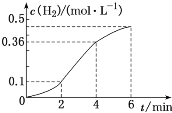
A.若将锌粒改为锌粉,可加快产生H2的反应速率
B.反应前4min内温度对反应速率的影响比浓度大
C.反应开始2min内平均反应速率最大
D.反应前4min内生成H2的平均速率v(H2)=0.09mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种新型消毒剂,可用氯酸钠(NaClO3)为原料制备。
(1)隔膜电解法制备ClO2的装置示意图如下:

已知:ClO2在酸性溶液中比较稳定,在碱性溶液中不能稳定存在。
①产生O2的电极反应式:________。
②结合反应方程式,简述ClO2的产生过程:_________。
(2)过氧化氢还原法制备ClO2:![]() 研究发现Cl-对上述反应有影响,实验记录如下:
研究发现Cl-对上述反应有影响,实验记录如下:
加入NaCl 的浓度/(g·L1) | ClO2的生成速率/(g·L-1·min-1) | 相同时间 | |||
10 min | 30 min | 60 min | ClO2 产率/% | Cl2 的量 | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | 极微量 |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | 极微量 |
①NaCl的主要作用是_______。
②上述反应可能的过程如下:
反应i:![]() +
+ ![]() + +
+ +
反应ii: Cl2 + H2O2 = 2Cl- + O2↑ + 2H+
将反应i填写完整_________。
③进一步研究发现,未添加Cl-时,体系中首先会发生反应生成Cl-,反应为:ClO3- + 3H2O2 = Cl- + 3O2↑+3H2O(反应iii)。分析反应i、ii、iii的速率大小关系并简要说明理由:_________。
(3)国家规定,饮用水中ClO2的残留量不得高于0.8 mg·L-1,检测步骤如下:
Ⅰ.取1.0L的酸性水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,使ClO2转化为![]() 。加入淀粉溶液,溶液变蓝。
。加入淀粉溶液,溶液变蓝。
Ⅱ.用0.0010 mol/LNa2S2O3溶液滴定步骤I中产生的I2。已知:步骤II中发生反应的离子方程式是![]()
①步骤I中发生的氧化还原反应的离子方程式是________。
②当步骤II中出现________(填现象)时,停止滴加Na2S2O3溶液,记录其体积为10.00 mL。
③上述水样中ClO2的残留浓度是______mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图所示。下列说法正确的是
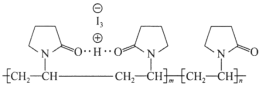 (图中虚线表示氢键)
(图中虚线表示氢键)
A.C、N、O原子的电负性依次增大
B.聚维酮碘中含有离子键、共价键、氢键等化学键
C.聚维酮易溶于水的原因是与水分子间形成氢键
D.分子中的含N五元环一定是平面结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com