
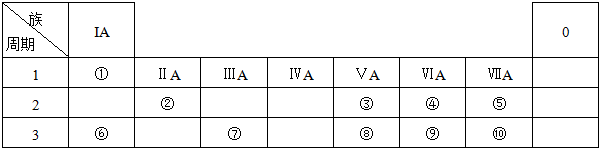
分析 短周期的四种元素A、B、C、D,它们的原子序数依次增大,A在周期表中原子半径最小,则A为氢元素,A、C位于同一主族,则C为钠元素,B、D的最外层电子数相等,即为同主族元素,且B、D的原子序数之和为A、C原子序数之和的两倍,则B为氧元素,D为硫元素,据此答题.
解答 解:短周期的四种元素A、B、C、D,它们的原子序数依次增大,A在周期表中原子半径最小,则A为氢元素,A、C位于同一主族,则C为钠元素,B、D的最外层电子数相等,即为同主族元素,且B、D的原子序数之和为A、C原子序数之和的两倍,则B为氧元素,D为硫元素,
在H、O、Na、S四种元素中,能形成漂白作用的物质有:SO2、H2O2、Na2O2、O3等,
故答案为:SO2、O3、H2O2、Na2O2.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握,题目难度中等,侧重于基础知识的综合应用能力的考查.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
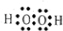
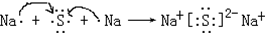
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
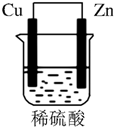 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏可以得到烷烃、环烷烃、芳香烃等产品 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 用于奥运火炬的丙烷是一种清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗1mol N2的同时,生成2mol NH3 | |
| B. | N2、H2、NH3的反应速率比为1:3:2的状态 | |
| C. | 1mol N≡N键断裂的同时,有6mol N-H 键断裂 | |
| D. | N2和H2浓度相等的时候 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

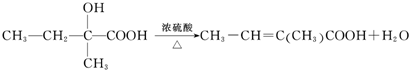
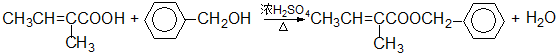
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
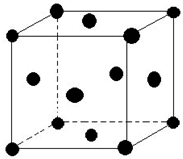 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com