
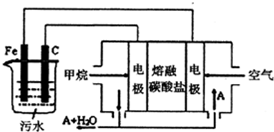
 电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.分析 (1)溶液导电能力较差,增大溶液中的离子浓度可以提高导电性,所以要加入不参与电解的物质;
(2)燃烧电池中,氧气在正极得电子,负极上甲烷失电子生成二氧化碳;
(3)阳极上Fe失电子生成亚铁离子,阴极上水电离的氢离子得电子生成氢气,同时生成氢氧根离子,亚铁离子与氢氧根离子结合生成Fe(OH)2,Fe(OH)2被氧气氧化为Fe(OH)3.
解答 解:(1)溶液导电能力较差,增大溶液中的离子浓度可以提高导电性,所以要加入不参与电解的物质,
a.沉降的原理是碱性环境下,让铁离子沉淀,若加入硫酸,则铁离子不会产生沉淀,无法达到实验目的,故a错误;
B.Na2SO4 电解时不参加反应,对产物氢氧化铁无影响,能提高导电性,故b正确;
C.加CuSO4 电解时铜离子会参加反应,故c错误;
D.CH3CH2OH是非电解质,不能提高导电性,故d错误;
故答案为:b;
(2)料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以正极反应为:O2+2CO2+4e-=2CO32-;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;负极上甲烷失电子生成二氧化碳,则负极电极反应是CH4+4CO32--8e-=5CO2+2H2O;
故答案为:正; CO2;CH4+4CO32--8e-=5CO2+2H2O;
(3)阳极上Fe失电子生成亚铁离子,其电极方程式为:Fe-2e-=Fe2+,阴极上水电离的氢离子得电子生成氢气,同时生成氢氧根离子,亚铁离子与氢氧根离子结合生成Fe(OH)2,则电解生成的固体产物是Fe(OH)2,Fe(OH)2被氧气氧化为Fe(OH)3,反应的方程式为 4Fe(OH)2+2H2O+O2=4Fe(OH)3;
故答案为:Fe-2e-=Fe2+;Fe(OH)2; 4Fe(OH)2+2H2O+O2=4Fe(OH)3.
点评 本题考查了电解原理的应用、铁的化合物的性质,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握电极放方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜作阴极 | |
| B. | 电解精炼铜时,溶液浓度基本不变 | |
| C. | 在铁制容器上镀铜时,可用CuSO4溶液作电镀液 | |
| D. | 在铁制容器上镀铜时,铁制容器连接外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 不纯物质 | 除杂试剂 | 分离方法 |
| ① | 苯(苯酚) | ||
| ② | 酒精(水) | ||
| ③ | 溴苯(Br2) | ||
| ④ | 乙烯(SO2) | ||
| ⑤ | 乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量8.70g食盐 | |
| B. | 用广泛pH试纸测定氯水的pH值为3.5 | |
| C. | 在蒸发皿中灼烧氢氧化铁获得铁红 | |
| D. | 用加热的方法分离氯化钠和氯化铵的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18H2O含有的氢原子数目为NA | |
| B. | 1molFe与足量盐酸反应失去的电子数为3NA | |
| C. | 标准状况下,22.4L等物质的量的CO2和O2混合气体中含有氧原子数为2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池和电解池都能实现能量的置换.回答下列问题:
原电池和电解池都能实现能量的置换.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com