
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
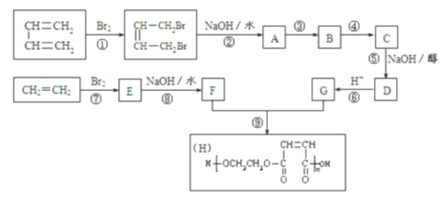
请按要求填空:
(1)写出上述指定反应的化学反应类型:
反应①____________,反应⑤______________,反应⑧________________。
(2)反应②的化学方程式是___________________________________________。
(3)反应③、④中有一反应是与HCl加成,该反应是__________(填反应编号),设计这一步反应的目的是___________________,物质C的结构简式是____________________。
(4)写出A的同分异构体(要求不含甲基并能发生银镜反应)__________________。
【答案】加成反应 消去反应 取代反应 ![]() +2NaOH→
+2NaOH→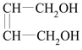 +2NaBr ③ 保护A分子中C=C(碳碳双键)不被氧化
+2NaBr ③ 保护A分子中C=C(碳碳双键)不被氧化  HO-CH2CH2CH2CHO
HO-CH2CH2CH2CHO
【解析】
由H可知F为HOCH2CH2OH,则E为BrCH2CH2Br,G为HOOCCH=CHCOOH,D为NaOOCCH=CHCOONa,反应②为溴代烃的水解反应,则A为HOCH2CH=CHCH2OH,由(3)信息可知B为HOCH2CH2CHClCH2OH,C为 ,结合对应物质的性质以及题目要求可解答该题。
,结合对应物质的性质以及题目要求可解答该题。
(1)由官能团的变化可知反应①为加成反应,反应⑤消去反应,反应⑧取代反应,故答案为:加成反应;消去反应;取代反应;
(2)反应②的化学方程式是![]() +2NaOH→
+2NaOH→ +2NaBr,故答案为:
+2NaBr,故答案为:![]() +2NaOH→
+2NaOH→ +2NaBr;
+2NaBr;
(3)由转化关系可知反应③④分别为加成和氧化反应,为保护C=C不被氧化,则反应③为加成反应,C为 ,故答案为:③;保护A分子中C=C不被氧化;
,故答案为:③;保护A分子中C=C不被氧化; ;
;
(4)A为HOCH2CH=CHCH2OH,A的同分异构体不含甲基并能发生银镜反应,说明有醛基,不含甲基,说明没有支链且羟基要连在端碳上,其结构简式为:HO-CH2CH2CH2CHO,故答案为:HO-CH2CH2CH2CHO。


科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4 和(NH4)2HPO4的废水中回收NH3·H2O和 H3PO4,装置如图所示。下列说法错误的是( )
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a处进入稀氨水,d处流出浓H3PO4溶液
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.每放出11.2L(标准状况)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过系列步骤可制备氯化铜晶体(CuCl22H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是__ (填字母编号)
a CuO b NaOH c Cu2(OH)2CO3 d Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl22H2O.
①蒸发过程中,加入盐酸的目的是____.
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是:![]()

上述反应的化学平衡常数表达式是______.欲使溶液由绿色变成蓝色的措施是:a______;b______.
(4)由CuSO4溶液蒸发结晶得到CuSO45H2O的过程中不用加入硫酸,其原因是______(用勒夏特列原理解释).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
抗肿瘤新药黄酮醋酸是一种化学合成的黄酮类化合物。临床前研究表明黄酮醋酸对于许多移植性肿瘤,特别是实体瘤,具有明显的抑制活性。它的合成路线如下:
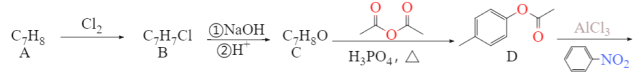
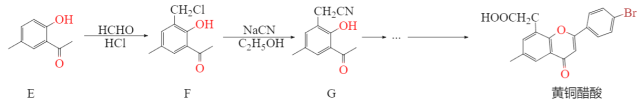
已知:RCN在酸性条件下发生水解反应:![]()
(1)A转化为B的反应条件是_______,写出B在一定条件下与NaOH 反应的化学方程式_______。
(2)有机物C的名称为_________,C转化为D的同时还生成了乙酸,写出反应的化学方程式_________。
(3)1 mol F最多可与_______ mol NaOH 反应。
(4)F转化为G的反应类型为__________,G的分子式为___,黄酮醋酸的含氧官能团有____(写官能团名称)。
(5)写出3个符合下列条件的E的同分异构体______。
①能发生银镜反应②遇FeCl3会发生显色反应③苯环上有4 种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法不正确的是( )

A.电池总反应式为:2Mg+ O2+2H2O=2Mg(OH)2
B.正极反应式为:Mg-2e-=Mg2+
C.活性炭可以加快O2在电极上的反应速率
D.电子的移动方向由a经外电路到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的一种工业生产过程如下:

下列说法中错误的是
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.“碱化”目的是让可溶性有机质形成沉淀
D.“氧化”是让I-转化为I2,可以用适量氯气作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
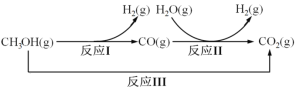
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
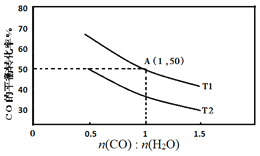
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
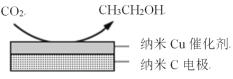
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
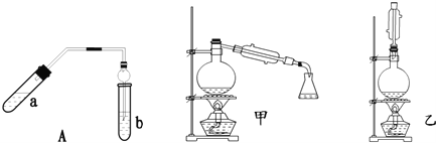
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com