
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )
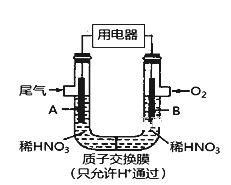
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为元素周期表前四周期的元素。其中X是形成化合物种类最多的元素,Y的内层电子数是最外层电子数的9倍,Z是元素周期表中电负性最大的元素,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题。
(1)W元素在元素周期表中的位置为______________________________。
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。写出该配离子的结构简式(标明配位键)_______。
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为__________,1mol该分子中σ键的数目为______________,该物质易溶于水的主要原因是________________。
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为______________________。

(5)元素Y与元素Z形成的晶胞结构如图②所示,该晶胞中Y离子周围最近的Z的离子为___个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对X+2Y=X2++2Y-的叙述中正确的是
A.Y被还原,X2+是还原产物 B.Y被还原,X发生氧化反应
C.X是还原剂,Y被氧化 D.X被氧化,X显氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
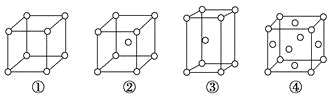
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构为…—CH=CH—CH=CH—CH=CH—CH=CH-…的高分子化合物用碘蒸气处理后,其导电能力大幅度提高。上述高分子化合物的单体是
A.乙炔 B.乙烯 C.丙烯 D.1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
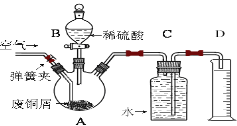
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是 。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为 。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②____________________________________________________________________
(3)为使A中固体加快溶解速率,以下方法运用合理的是 。
a.对A装置加热;b.向A内加入少量Fe2O3;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO4;f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是 。
②检验溶液中铁元素是否被完全沉淀最好的方法是___________
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石的熔点为a℃,晶体硅的熔点为b℃,足球烯(分子式为C60)的熔点为c℃,三者熔点的大小关系是
A. a>b>c B. b>a>c C. c>a>b D. c>b>a.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com