
����Ŀ��һ�������´��ڷ�Ӧ��CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H����Q kJ/mol(Q>0)������������ͬ��2 L���ݾ���(�����û����������)�ܱ����������������������г���1 mol CO��1 mol H2O�������г���1 mol CO2��1 mol H2�������г���2 mol CO��2 mol H2O��700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ�������������̶�Ӧ�������仯ֵ�ֱ�ΪQ1��Q2��Q3������˵����ȷ����
CO2(g)��H2(g)����H����Q kJ/mol(Q>0)������������ͬ��2 L���ݾ���(�����û����������)�ܱ����������������������г���1 mol CO��1 mol H2O�������г���1 mol CO2��1 mol H2�������г���2 mol CO��2 mol H2O��700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ�������������̶�Ӧ�������仯ֵ�ֱ�ΪQ1��Q2��Q3������˵����ȷ����
A. 2Q1��2Q2��Q3
B. ��������CO�İٷֺ�������������CO�İٷֺ�����
C. �������з�Ӧ��ƽ�ⳣ�����������з�Ӧ��ƽ�ⳣ��С
D. ��������CO��ת��������������CO2��ת����֮�͵���1
���𰸡�C
��������A���������д�����Ӧ��ʼ����ƽ�⣬�÷�ӦΪ���ȣ��������д��淴Ӧ��ʼ����÷�ӦΪ���ȣ����Ƚ�Q1��Q2�Ĵ�С����A����B�����������൱������������ƽ��Ļ������ټ���1molCO��1molH2O��ѹǿ��Ӱ��û�ѧƽ�⣬��Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�����ƽ�������ƶ�������������CO��ת���ʵͣ�CO�İٷֺ����ߣ�������������CO�İٷֺ�������������CO�İٷֺ����ͣ���B����C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�����ƶ������������еķ�Ӧ��ƽ�ⳣ������������C��ȷ��D���¶���ͬʱ������I��CO��ת��������������CO2��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���������̼��ת���ʱ���������ͬ�¶�ʱ��������CO2��ת���ʵͣ�����������CO��ת��������������CO2��ת����֮��С��1����D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ����~�������ڱ��е�λ�������ʾ���Իش��������⡣
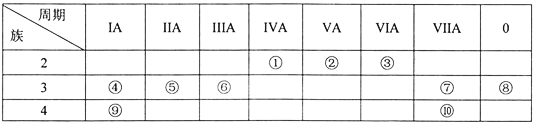
��1������10��Ԫ���У���ѧ��������õ���___(��Ԫ�ط��ţ���ͬ)����ˮ��Ӧ��ҵĽ���Ԫ����___________��
��2��Ԫ��������̬�⻯��ķ���ʽ��_____������10��Ԫ���У�������������Ӧˮ�����������ǿ��������_______(�ѧʽ)��
��3��Ԫ���������γɵij������������Ļ�����ĵ���ʽ_________��
��4���٢ڢ�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
����һ����ѧ����ʽ(�����ӷ���ʽ)˵��Ԫ���������ǽ����Ե�ǿ����_____��
��5����������Ԫ�ص�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ᷢչϢϢ��أ�����˵������ȷ���ǣ� ��
A.�����������Ѽ�·�������������γɵ����ܽ��ж����ЧӦ
B.����������������֮�Ϊͭ�����ù��̷������û���Ӧ
C.��������ȡ�����ؼ���������ȡ���˹������ڻ�ѧ�仯
D.�����ϵ���˿����������ɻ���ʼ����ʫ�����漰��ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ݸ�Ŀ�������վ�����ĿΪ������Ԫʱʼ���䷨����Ũ�ƺ�����굣��������ϡ���������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ
A.����B.��ȡC.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����ѧ�������ܵ�ת����ijʵ��С���������������ʵ��װ�ã�
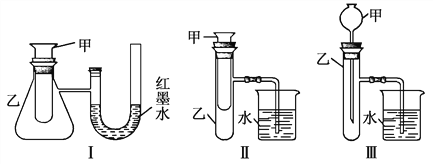
��1������3��װ���У�����֤����ͭ��Ũ���ᷴӦ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ������___________________��
��2��ijͬѧѡ��װ��������ʵ��(ʵ��ǰU�ι���Һ��������ƽ)���ڼ��Թ��������������������Һ��ϡ���ᣬU�ι��пɹ۲쵽��������___________________��˵���÷�Ӧ����___________________(��������������������)��Ӧ��
��3��Ϊ̽������M����ˮ����ЧӦ��ѡ��װ��������ʵ��(��Ӧ�ڼ��н���)��
����MΪ�ƣ���ʵ��������ձ��пɹ۲쵽��������___________________��
�����۲쵽�ձ���������ݣ���˵��M����ˮ___________________ (����һ���Ƿ��ȷ�Ӧ����һ�������ȷ�Ӧ�����������Ƿ��ȷ�Ӧ��)��������___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī���缫���KCl��CuSO4���������ϣ������Һ������������ҺpH��ʱ��t�ı仯��ͼ��ʾ������˵����ȷ����
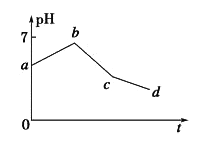
A. ab��H+����ԭ����Һ��pH ����
B. cd ���൱�ڵ��ˮ
C. c��ʱ��������CuCl2���壬���Һ�ɻָ�ԭ��Ũ��
D. ԭ��Һ��KCl��CuSO4�����ʵ���Ũ��֮��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�а�������Ϣ����������������ȷ���� ( )
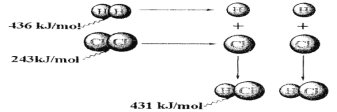
A��������������Ӧ����1 mol�Ȼ������壬��Ӧ����248 kJ������
B��436 kJ/mol��ָ�Ͽ�1 mol H2�е�H��H����Ҫ�ų�436 kJ������
C��������������Ӧ����2 mol�Ȼ������壬��Ӧ�ų�183 kJ������
D��431kJ/mol��ָ����2 mol HCl�е�H��Cl����Ҫ�ų�431 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����4FeS2+11O2�T2Fe2O3+8SO2���Իش��йص����⣺
��1����ѡ����Щ����Ũ�ȵı仯����ʾ�÷�Ӧ������____________��
��2��Ϊ���������SO2�����ʣ����Բ�ȡ�Ĵ�ʩ��______________��
A������FeS2���� B������O2��Ũ�� C�������¶� D����Сѹǿ
����ij���淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0��3���Ӹ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩
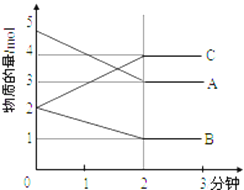
��3���÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
��4����һ���¶��£����������ܱ������У�������Ӧ�ﵽƽ��ı�־��_______________
A���������������ֲ���
B��A��B��C��Ũ�ȶ����
C��A��B��C��Ũ�Ȳ��ٷ����仯
D��A��B��C�ķ�����֮��Ϊ2��1��2
E������Ӧ���淴Ӧ����ֹͣ
F�������������ܶȲ��ٷ����仯��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com