
【题目】黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
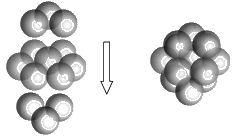
①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
【答案】(1)1s22s22p63s23p6;(2)Fe3+的基态电子排布式为[Ar]3d5,价层电子是半满状态,个轨道电子均处于稳定状态,Fe2+的基态电子排布式为[Ar]3d6,3d轨道电子不是稳定状态,所以常温下Fe3+比Fe2+要更加稳定;(3)极性共价键和非极性共价键,sp2杂化,O3、NO2-;(4)H2SO4和H2SO3都是S的含氧酸,结构分别为 ,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①6;②5.06.
,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①6;②5.06.
【解析】
试题分析:(1)(1)在FeS2中的S2-的核外电子排布式是1s22s22p63s23p6,答案为:1s22s22p63s23p6;(2)Fe3+的基态电子排布式为[Ar]3d5,价层电子是半满状态,个轨道电子均处于稳定状态,Fe2+的基态电子排布式为[Ar]3d6,3d轨道电子不是稳定状态,所以常温下Fe3+比Fe2+要更加稳定,答案为:Fe3+的基态电子排布式为[Ar]3d5,价层电子是半满状态,个轨道电子均处于稳定状态,Fe2+的基态电子排布式为[Ar]3d6,3d轨道电子不是稳定状态,所以常温下Fe3+比Fe2+要更加稳定;(3)H2S2分子和过氧化氢分子互为等电子体,过氧化氢的电子式为![]() ,分子中含有极性共价键和非极性共价键,所以H2S2分子的共价键的类型极性共价键和非极性共价键,SO2分子中的S原子的价层电子对数为2+(6-2X2)/2=3,S原子杂化轨道类型是sp2杂化,SO2是三原子,18电子的分子,与O3和NO2-互为等电子体,答案为:极性共价键和非极性共价键,sp2杂化,O3、NO2-;(4)H2SO4和H2SO3都是S的含氧酸,结构分别为
,分子中含有极性共价键和非极性共价键,所以H2S2分子的共价键的类型极性共价键和非极性共价键,SO2分子中的S原子的价层电子对数为2+(6-2X2)/2=3,S原子杂化轨道类型是sp2杂化,SO2是三原子,18电子的分子,与O3和NO2-互为等电子体,答案为:极性共价键和非极性共价键,sp2杂化,O3、NO2-;(4)H2SO4和H2SO3都是S的含氧酸,结构分别为 ,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强,答案为:H2SO4和H2SO3都是S的含氧酸,结构分别为
,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强,答案为:H2SO4和H2SO3都是S的含氧酸,结构分别为 ,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①每个Fe2+周围最近的等距离的S22-离子存在于面心,共有六个,答案为:6;②一个晶胞中含有Fe2+数目为
,硫酸中的非羟基氧原子比亚硫酸中多,S原子所带正电荷高,导致S-O-H中O的电子偏向S,因而在水分子的作用下H2SO4比H2SO3容易电离出H+,故H2SO4比H2SO3酸性强;(5)①每个Fe2+周围最近的等距离的S22-离子存在于面心,共有六个,答案为:6;②一个晶胞中含有Fe2+数目为![]() ,含有S22-数目为
,含有S22-数目为![]() ,一个晶胞的质量为:
,一个晶胞的质量为:![]() ,一个晶胞的体积为
,一个晶胞的体积为![]() ,已知FeS2的晶胞参数是a0=0.54nm,它的密度为5.06g·cm-3,答案为:5.06.
,已知FeS2的晶胞参数是a0=0.54nm,它的密度为5.06g·cm-3,答案为:5.06.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。

请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并填上所需的微粒:
_________ H++ _________ MnO4-+ _________ H2C2O4→_________ CO2↑+ _________ Mn2++ _________□
(2)该反应中的还原剂是_________。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为_________ mol.
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是_________.
②溶解沉淀时_________(能或不能)用稀盐酸,原因是_________。
③若消耗了1.0×10-4mol/L的溶液20.00mL,则100mL该血液中含钙_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:

(1)Y元素位于周期表中的第__________族,
(2)化合物Q2Z2中含有的化学键类型有__________。
(3)用电子式表示化合物QR的形成过程:__________。
(4)Y2X4与AgNO3溶液反应可生成Ag、Y2和硝酸,写出该反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:

(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为 (写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料。合成铃兰醛的路线如图所示(部分试剂和条件未注明):

已知:![]()
![]()
请回答下列问题:
(1)D的结构简式是_______________;
(2)生成E的化学方程式是___________________________________________;
(3)下列有关G的叙述中,不正确的是______(填序号)。
A.G分子中有4种不同化学环境的氢原子
B.G能发生消去反应、氧化反应和还原反应
C.1molG最多能与5molH2发生加成反应
(4)H的同分异构体有多种,试写出满足以下条件的一种结构简式:__________。
①遇FeCl3溶液呈紫色,②核磁共振氢谱中有四种类型氢原子的吸收峰。
(5)在F向G转化的过程中,常伴有分子式为C17H22O的副产物K产生,K的结
构简式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸浆漂白和鱼药的制造。制备亚氯酸钠的工艺流程如下:

(1)要加快步骤①的反应速率,可采取的措施为 。(写一种即可)
(2)步骤①的离子方程式为 ,每生成标准状况下22.4L的ClO2,转移电子数为 。
(3)步骤②中H2O2的作用是 ;从“反应混合液”到“产品”的过程中先需蒸发溶剂,写出蒸发所需的硅酸盐仪器的名称 。
(4)NaClO2产品中通常混有少量NaCl。取样品wg,测得Na的物质的量为nmol,则该样品中NaClO2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) D元素在周期表中的位置是________,中子数为14的E原子可表示为________。
(2)写出由A和C形成的化合物的化学式 ,该化合物由 键形成。
(3) A、B、C、D、E五种元素的离子半径由小到大的顺序是________(用离子符号填写)。
(4)写出实验室制取A的气态氢化物的化学方程式:________________________________。
(5)简述比较D与E金属性强弱的实验方法:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:
2Fe+2H2O+O2=2Fe(OH)2。Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈。请根据图示,回答下列问题:

(1)在上述电化学腐蚀中,碳(C)作 极。
(2)写出负极的电极反应式 。
(3)工业上,常在钢铁设备的表面涂一层油,其作用是 。
A.减少钢铁与空气和水的接触,防止在钢铁表面形成微小原电池
B.隔绝钢铁与空气和水的接触,阻止在钢铁表面形成微小电解池
C.润滑设备,防止灰尘污染
D.防止人为接触设备,避免设备腐蚀
(4)如果将长期浸泡在河水中的钢铁闸门与外电源连接防腐,应将闸门连接外部直流电源的 极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com