
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,电子从负极流向正极;由此分析解答.
解答 解:A、铜为正极,正极上氢离子得电子生成氢气,所以正极上有H2逸出,故A错误;
B、铜为正极,正极上氢离子得电子生成氢气,所以铜片上有H2逸出,故B正确;
C、原电池放电时,电子从负极流向正极,则电子通过导线由锌片流向铜片,故C错误;
D、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以硫酸根离子向负极移动,则负极附近的 SO42- 离子浓度逐渐增大,故D错误;
故选:B.
点评 本题考查了原电池原理,题目难度不大,注意把握原电池中正负极的判断、电子流向和离子移动方向,侧重于考查学是的分析能力.


科目:高中化学 来源: 题型:解答题
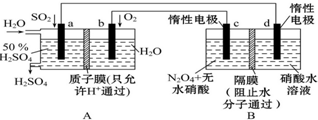 膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:
膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
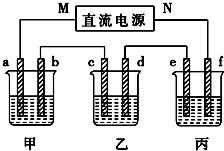 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
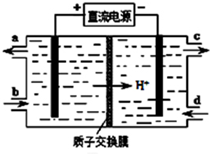
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
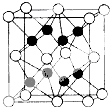 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题: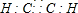 、
、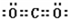 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
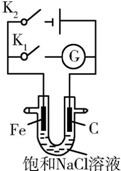
| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液的pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002NA个电子时,两极共产生0.002 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,不能用水来扑灭,可用CO2灭火 | |
| B. | 钠跟CuSO4溶液反应生成的蓝色沉淀上有时会出现暗斑,这是因为析出了金属铜 | |
| C. | 钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 | |
| D. | 2.3 g钠与97.7 g水反应后溶液中溶质的质量分数大于4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属离子在反应中可能被氧化、也可能被还原 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗的Zn的质量为97.5 g | B. | 气体A中SO2和H2的体积比为1:4 | ||
| C. | 反应中被还原的元素只有一种 | D. | 反应中共转移电子3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com