
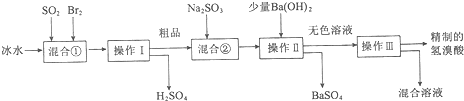
分析 制备溴化氢的流程中,二氧化硫与溴水反应生成氢硫酸和硫酸,采用冰水是为了降低体系温度,防止溴蒸发,根据不同温度溶解性的不同,分离含有挥发出来的溴和氢溴酸的混合物,在用亚硫酸钠溶液除去氢溴酸中的杂质溴单质,但此过程引入杂质离子硫酸根,故用氢氧化钡除去,最终制备较纯净的氢溴酸,据此分析回答,
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;
(3)Br2氧化SO2放出很多热量,溴易挥发;粗品中可能含有为反应的Br2,应除去Br2;
(4)①用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验;
(5)用Ba(OH)2会引入HCl或HNO3杂质,而使制备的氢溴酸不存.
解答 解:制备溴化氢的流程中,二氧化硫与溴水反应生成氢硫酸和硫酸,采用冰水是为了降低体系温度,防止溴蒸发,根据不同温度溶解性的不同,分离含有挥发出来的溴和氢溴酸的混合物,在用亚硫酸钠溶液除去氢溴酸中的杂质溴单质,但此过程引入杂质离子硫酸根,故用氢氧化钡除去,最终制备较纯净的氢溴酸,
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤,
故答案为:过滤;
(3)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全,粗品中可能含有为反应的Br2,加入Na2SO3,除去粗品中未反应完的溴,
故答案为:降低体系温度,防止溴蒸发,使反应完全;除去粗品中未反应完的溴;
(4)①用KSCN溶液检验Fe3+,取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+,
故答案为:KSCN溶液;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验,取少许溶液加振荡、静置分层,下层呈橙红色,说明氢溴酸呈淡黄色是因为含Br2,
故答案为:Br2;CCl4;
(5)用BaCl2或Ba(NO3)2会引入HCl或HNO3杂质,而使制备的氢溴酸不存,故不能用BaCl2或Ba(NO3)2代替Ba(OH)2,
故答案为:否;会引入HCl或HNO3杂质,而使制备的氢溴酸不存否 会引入HCl或HNO3杂质,而使制备的氢溴酸不存.
点评 本题以制备氢溴酸为载体,考查学生对工艺流程的理解、物质的分离提纯等基本操作、离子检验、物质性质等,难度中等,是对知识的综合运用,需学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
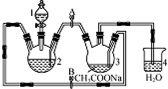 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
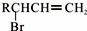 .
.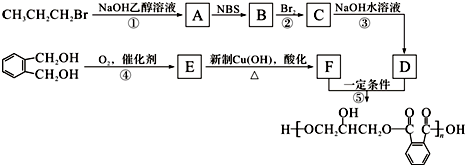
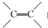 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.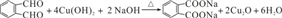 ;
;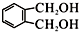 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.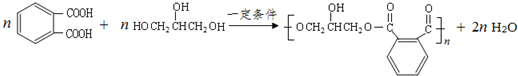 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除④⑦外 | B. | 除③⑥外 | C. | ①②⑤ | D. | 除④外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

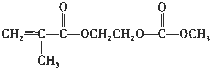 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: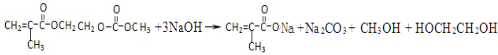 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com