
| A、①④ | B、②③ | C、③④ | D、②④ |


科目:高中化学 来源: 题型:
 对叔丁基苯酚
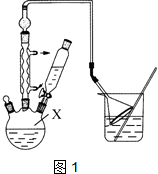
对叔丁基苯酚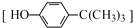 可用于生产油溶性酚醛树脂等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
可用于生产油溶性酚醛树脂等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1>c2>c3 |
| B、c1>c3>c2 |
| C、c1=c3>c2 |
| D、c1=c2>c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
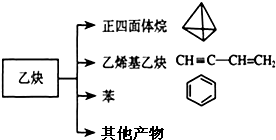 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 原因解释 |
| A | 将一片较簿的铝片放在酒精灯火焰上灼烧 | 铝片慢慢熔化呈液滴状 | 铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低熔化了 |
| B | 将等表面积的镁条、铝 片(均除去氧化膜)分 别放入装有等浓度、等 体积盐酸的两支试管中 | 都产生气泡,镁条表面产生气泡更快 | 镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快 |
| C | 在打磨过的铁片上先滴 一滴饱和食盐水,再滴 一滴酚酞 | 液滴的外圈先出现红色 | 铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增大,溶液呈碱性 |
| D | 取少量淀粉加稀硫酸, 加热几分钟,冷却后加 入新制氢氧化铜悬浊 液,加热至沸腾 | 未见砖红色沉淀生成 | 淀粉水解后没有葡萄糖生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g/L |
| 排放标准 | pH 6~9 | 0.5mg/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都会水解 |
| B、丁烷(C4H10)和二氯甲烷都存在同分异构体 |
| C、只用新制的Cu(OH)2悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液 |
| D、汽油、柴油、植物油都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com