
| A. | 由元素X与Z形成的化合物中只含共价键 | |
| B. | XY2、ZY2、M2Y2的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | X的氢化物X2H2分子中含有2个σ键和3个π键 |
分析 X、Y、Z、M为4种短周期元素,Z的单质可制成半导体材料,可知Z为Si元素;Y2-与M+的电子层结构相同,可知M为Na,Y为O,Z与X的原子核外最外层电子数相同,X、Y位于同周期且原子半径r(X)>r(Y),则X为C,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Si,M为Na,
A.由元素X与Z形成的化合物为SiC,只含共价键,故A正确;
B.CO2、SiO2、Na2O2的晶体分别为分子晶体、原子晶体、离子晶体,属于3种不同类型的晶体,故B正确;
C.单质Na的晶体和K相似,是体心立方堆积,Na的配位数是8,故C正确;
D.C的氢化物C2H2分子中的结构式为H-C≡C-H,含有3个σ键和2个π键,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、原子结构推断元素为解答的关键,侧重分析与推断能力的考查,注意晶体类型及化学键的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-O | O═O | Si-Si |
| 键能/kJ•mol-1 | x | 498.8 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| C. | 含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中 | |
| D. | Fe2O3常用于生产红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在:Al3+、NH4+、S2-、Cl- | |
| B. | 酸性溶液中可能大量存在:I-、ClO-、SO42-、Na+ | |
| C. | 中性溶液中可能大量存在:SO42-、K+、Fe3+、Cl- | |
| D. | 弱碱性溶液中可能大量存在:Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
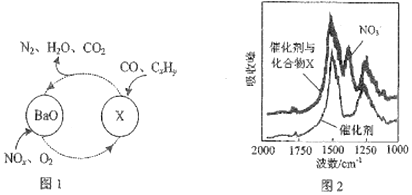
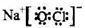 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③④ | B. | 只有①② | C. | 只有①③⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com