
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
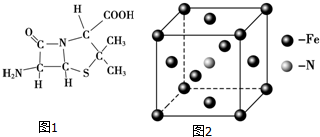
分析 (1)体心立方晶胞中每个Fe原子周围有8个Fe原子,Fe属于26号元素,电子排布式为1s22s22p63s23p63d64s2;
(2)根据价层电子对互斥理论判断NO3-的空间构型;原子个数相等价电子数相等的微粒是等电子体,正负电荷重心重合的分子是非极性分子;
(3)根据价层电子对互斥理论确定原子杂化方式;
(4)a.氢键的存在影响物质的熔沸点;
b.根据化合物中化合价的代数和为0计算;
c.聚乙烯(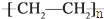 )分子中有(6n-1)个σ键;
)分子中有(6n-1)个σ键;
d.60gSiO2的物质的量=$\frac{60}{60}$=1mol,一个硅原子含有4个硅氧键;
(5)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式;
设正四面体的棱长为xcm,则正四面体的面对角线为$\sqrt{2}$xcm,又两个最近的Fe原子间的距离为scm,所以$\frac{\sqrt{2}}{2}$x=s,则x=$\sqrt{2}$scm,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)心立方晶胞中每个Fe原子周围有8个Fe原子,故晶胞中该原子的配位数为8,Fe属于26号元素,电子排布式为1s22s22p63s23p63d64s2,其中3d轨道中有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d6,故答案为:8;4;1s22s22p63s23p63d6;
(2)NO3-中N原子价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,与N03-互为等电子体的一种非极性分子有:BF3[SO3( g)、BBr3等],故答案为:平面正三角形;BF3[SO3( g)、BBr3等];
(3)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S,故答案为:C、N、O、S;
(4)a.乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高,故正确;
b.根据化合物中化合价的代数和为0知,钨的配合物离子[W(CO)5OH]-中钨显0价,故错误;
c.聚乙烯(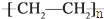 )分子中有(6n-1)个σ键,故错误;
)分子中有(6n-1)个σ键,故错误;
d.由表中数据知反应Si(s)+O2(g)=SiO2(s)中,每生成60gSiO2放出的能量为(4c-2a-b)kJ,故错误;
故答案为:a;
(5)该晶胞中铁原子个数=8×$\frac{1}{8}$+$6×\frac{1}{2}$=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,
设正四面体的棱长为xcm,则正四面体的面对角线为$\sqrt{2}$xcm,又两个最近的Fe原子间的距离为scm,所以$\frac{1}{2}\sqrt{2}$x=s,则x=$\sqrt{2}$scm,根据ρ=$\frac{m}{V}$=$\frac{\frac{56×4+14}{{N}_{A}}}{(\sqrt{2}s)^{3}}$=$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$.
故答案为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2;$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$.
点评 本题考查较综合,电子数排布式的书写、杂化方式的判断、晶胞的计算都是学习重点,难点是(4)cd选项,c选项中利用数学归纳法分析,d选项中明确硅、二氧化硅的空间结构是解此选项是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
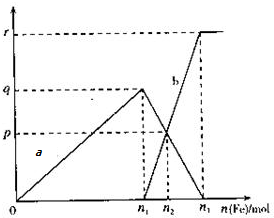 在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:
在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com