
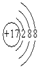

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)分析 短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子带两个单位正电荷,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,HCl的物质的量=0.1L×0.2mol/L=0.02mol,由AO+2HCl═ACl2+H2O,可知0.4gAO的物质的量为0.01mol,则M(AO)=$\frac{0.4g}{0.01mol}$=40g/mol,故A的摩尔质量为40g/mol-16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,以此解答.
解答 解:短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子带两个单位正电荷,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,HCl的物质的量=0.1L×0.2mol/L=0.02mol,由AO+2HCl═ACl2+H2O,可知0.4gAO的物质的量为0.01mol,则M(AO)=$\frac{0.4g}{0.01mol}$=40g/mol,故A的摩尔质量为40g/mol-16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,
(1)综上所述,A为Mg,B为Al,名称分别为镁和铝,故答案为:镁;铝;
(2)Cl的质子数为17,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)D为碳元素,最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为: ,故答案为:
,故答案为: ;
;
(4)Cl、Mg两元素形成的化合物为MgCl2,MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,故答案为:
,故答案为: ;
;
(5)Al与氢氧化钠反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置结构性质关系及其应用,侧重对化学用语的考查,推断元素是解答关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 电解水:2H20=2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+H2O=4HF+O2 | D. | 3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离常数随着弱电解质浓度的增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$ | |
| C. | 电离常数只受温度影响,与浓度无关 | |
| D. | CH3COOH溶液中加入少量CH3COONa固体,电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>Cl>Br>I | B. | 单质氧化性:F2>Cl2>Br2>I2 | ||
| C. | 氢化物稳定性:HF>HCl>HBr>HI | D. | 沸点:F2>Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)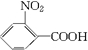 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯一次性超薄袋可用于包装食品 | |
| B. | 利用电渗析法和离子交换法能获得纯净水 | |
| C. | 体积分数为95%的酒精用作医用酒精 | |
| D. | 石油裂化的目的是得到乙烯、丙烯等化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于零即可 | B. | 大于0.6mol | C. | 大于或等于1mol | D. | 任意值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com