
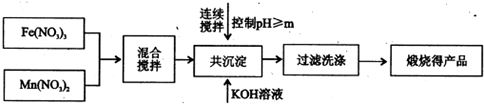
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
| ||
| x |
| 2 |
| ||
| ||
| ||
| x |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ①+② |
| x |
| a+b |
| x |
| 1 |
| 2 |
| a+b |
| x |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| △ |
| ||
| △ |
| ||
| ||
| 压强Mpa 转化率% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 沸腾炉温度 | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学-选修2:化学与技术】(15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有__________、__________。
(2)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是_____。
(3)水的净化和软化的区别是__________。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然
水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为
_________。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2__________g,后加入Na2CO3___________g。
查看答案和解析>>
科目:高中化学 来源:2012届宁夏银川一中高三第三次模拟考试化学试卷(带解析) 题型:填空题
【化学-选修2:化学与技术】(15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有__________、__________。
(2)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是_____。
(3)水的净化和软化的区别是__________。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然
水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为
_________。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2__________g,后加入Na2CO3___________g。
查看答案和解析>>
科目:高中化学 来源:2013届河北省五校联盟高三上学期调研考试理科综合化学试卷(解析版) 题型:实验题
【化学—选修2:化学与技术】(15分)
工业上采用电解饱和食盐水的方法生产烧碱和氯气。
Ⅰ.电解饱和食盐水之前,需精制食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-、及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是 。
A.④②①⑤③ B.④①②⑤③ C.②⑤④①③
D.②④⑤①③ E.⑤②④①③ F.⑤④②①③
Ⅱ.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
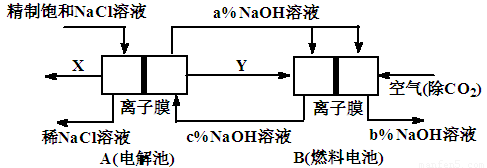
⑴图中X、Y分别是_____、______(填化学式)
⑵分别写出燃料电池B中正极、负极上发生的电极反应
正极:___________ __; 负极:___________ ____;
⑶为什么必须将空气中的二氧化碳除去才能通入燃料电池? 。
⑷分析比较图示中氢氧化钠质量分数a%、b%和c%的大小 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省许昌新乡平顶山高三第一次调研考试理科综合试题(化学部分) 题型:填空题
【化学——选修2:化学与技术】(15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 、 。
(2)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是 。
(3)水的净化和软化的区别是 。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.2×10—3mol/L,c(Mg2+)=6×10—4mol/L,则此水的硬度为 。
(5)若(4)中的天然水还含有c(HCO3—)=8×10—4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 g,后加入Na2CO3 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com