
氯碱工业中电解饱和食盐水时,用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用_____________________________________________________________。
科目:高中化学 来源: 题型:
用如下图所示装置进行下列实验。
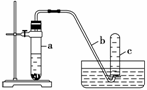
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L-1硝酸和1 g Cu片,立即将带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式
________________________________________________________________________
________________。
(1) 实验过程中反应开始时速率缓慢,随后逐渐加快,这是由于
________________________________________________________________________,
当反应进行一段时间后速率又逐渐减慢,原因是
________________________________________________________________________
________________________________________________________________________。
(3)欲较快地制得NO,可采取的措施是( )
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是(双选)( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的氧化性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
证明NaHSO3溶液中HSO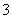 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
查看答案和解析>>
科目:高中化学 来源: 题型:
将Ca(OH)2加入蒸馏水中,一段时间后达到沉淀溶解平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)。下列说法中正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.恒温下向溶液中加CaO后,溶液中的n(OH-)减小
D.向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,H2SO3HSO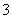 +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为H2CO3在加入强酸或强碱溶液溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
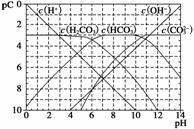
(1)在人体血液中,HCO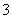 能起到使人体血液pH保持在7.35~7.45的作用。
能起到使人体血液pH保持在7.35~7.45的作用。
①请用电解质溶液中的平衡解释:__________________(用离子方程式表示)。
②正常人体血液中,HCO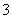 的水解程度________电离程度(填“<”、“>”或“=”)。
的水解程度________电离程度(填“<”、“>”或“=”)。
③pH=7.00的血液中,c(H2CO3)________c(HCO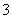 )(填“<”、“>”或“=”)。
)(填“<”、“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值Ka1≈________。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO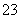 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确______________________。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确______________________。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1、c(CO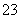 )=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是(双选)( )
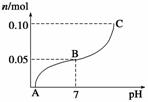
A.A点时pH=1
B.恰好完全沉淀时Ba(OH)2的体积为2 L
C.B点时,溶液中的离子浓度关系为c(Na+)>c(SO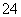 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.C点时pH=14
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)物质发生化学变化时,物质的总能量和总质量保持不变( )
(2)化学变化中一定同时存在着化学键的断裂和形成( )
(3)在化学变化中分子和原子的种类及数目都不发生变化( )
(4)电解质溶液导电时,必然伴随着化学变化( )
(5)化学变化中常伴随着发光、放热和颜色变化,因而有发光、放热和颜色变化的变化一定是化学变化( )
(6)铁粉加入FeCl3溶液中的反应既属于化合反应,又属于离子反应,还属于氧化还原反应( )
(7)氢氧根离子的电子式:[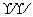

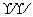 H]-( )
H]-( )
(8)乙烯的结构简式:CH2CH2( )
(9)明矾的化学式:Al2(SO4)3·12H2O( )
(10)PM2.5在空气中形成气溶胶( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com