
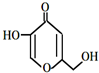
| A. | 分子中所有碳原子可能共平面 | |
| B. | 既能发生酯化反应又能发生氧化反应 | |
| C. | 1 mol该物质与H2完全加成,需消耗3 mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有2种 |
分析 该分子中含有碳碳双键、醇羟基、醚键、羰基,具有烯烃、醇、醚和酮的性质,能发生加成反应、加聚反应、取代反应等,据此分析解答.
解答 解:A.该分子中含有碳碳双键、碳氧双键,具有烯烃结构,亚甲基具有甲烷结构,则分子中所有碳原子可能共平面,故A正确;
B.含有醇羟基,能发生酯化反应,碳碳双键能发生氧化反应,故B正确;
C.碳碳双键和碳氧双键能和氢气在一定条件下发生加成反应,则1 mol该物质与H2完全加成,需消耗3 mol H2,故C正确;
D.该分子的不饱和度是4,苯环的不饱和度是4,比该物质少一个O原子,则分子式为C6H6O3,该分子的不饱和度=$\frac{6×2+2-6}{2}$=4,属于芳香族化合物含有3个羟基,符合条件的同分异构体有3种,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、烯烃和酮的性质,易错点是D.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
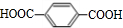 +2NaHCO3→
+2NaHCO3→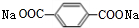 +2H2O+2CO2↑.
+2H2O+2CO2↑.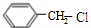 .
.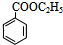 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$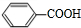 +CH3CH2OH.
+CH3CH2OH.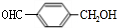 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n +n
+n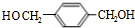 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$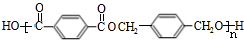 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) | |
| D. | 反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
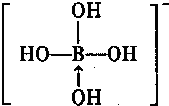 .(若存在配位键需标出)
.(若存在配位键需标出)
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
| A. | 平衡时SO3的物质的量:a>1.2、b>1.2 | |
| B. | 容器Ⅱ、Ⅲ中平衡常数相同 | |
| C. | 容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 | |
| D. | 若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),则此时ν正<ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
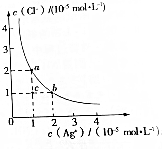
| A. | a点和b点对应的Ksp(AgCl)相等 | |
| B. | Ksp(AgCl)=2×10-10 | |
| C. | 可采取蒸发溶剂的方法使溶液从c点变到b点 | |
| D. | 已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=4.25×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一氯代物只有一种 | B. | 苯的邻位二氯代物只有一种 | ||
| C. | 苯的间位二氯代物只有一种 | D. | 苯的对位二氯代物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com