
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
分析 弱电解质在水溶液里存在电离平衡,强电解质在水溶液里完全电离,所以物质的量浓度相等的盐酸和醋酸,醋酸的pH大于盐酸,pH相等的氨水和氢氧化钠溶液,氨水浓度大于氢氧化钠溶液,
A.酸或碱抑制水电离,氢离子或氢氧根离子浓度越大,对水电离的抑制程度越大;
B.三种溶液的物质的量浓度均为0.01 mol•L-1,根据反应方程式判断;
C.加水稀释促进弱电解质的电离;
D.氯化铵是强酸弱碱盐,要使氨水和盐酸的混合溶液呈中性,则一水合氨的物质的量稍微大些.
解答 解:弱电解质在水溶液里存在电离平衡,强电解质在水溶液里完全电离,所以物质的量浓度相等的盐酸和醋酸,醋酸的pH大于盐酸,pH相等的氨水和氢氧化钠溶液,氨水浓度大于氢氧化钠溶液,
A.酸或碱抑制水电离,氢离子或氢氧根离子浓度越大,对水电离的抑制程度越大,①中水的电离程度最大,②③④中水的电离程度相等,故A错误;
B.三种溶液的物质的量浓度均为0.01 mol•L-1,Al与酸、碱反应的离子方程式为:2Al+6H+=2Al++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑,所以与碱反应生成的氢气多,即生成H2的量:④最大,故B正确;
C.①②稀释相同的倍数,盐酸溶液中氢离子浓度大于醋酸,所以pH①>②;③④稀释相同的倍数,稀释过程中促进一水合氨电离,导致氨水中氢氧根离子浓度大于氢氧化钠溶液,则pH③>④,故C错误;
D.氯化铵是强酸弱碱盐,要使氨水和盐酸的混合溶液呈中性,则一水合氨的物质的量稍微大些,氨水浓度大于盐酸,要使混合溶液呈中性,则消耗溶液的体积可能:②>③,故D错误;
故选B.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断等知识点,明确弱电解质电离特点是解本题关键,知道哪些物质促进水电离哪些物质抑制水电离,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
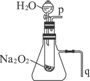 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管内气体呈红棕色 | B. | 试管内气体无色,是NO | ||
| C. | 试管内气体无色,是O2 | D. | 试管内液面下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
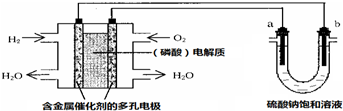
| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是$\frac{71W}{161(W+36a)}$×100% | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.01g O2时,b 极周围会产生0.02g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 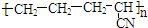 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 | |
| C. | 等质量的甲醛和乳酸[CH3CH(OH)COOH]完全燃烧消耗的氧气不相等,但生成水的质量相等 | |
| D. | 分析反应: ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com