
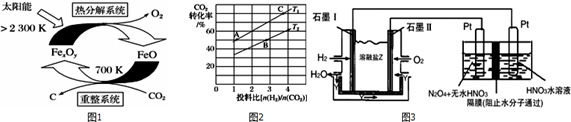
分析 (1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,根据原子守恒确定FexOy的化学式;
②热分解系统中是FexOy分解为FeO与氧气,根据Fe元素化合价变价计算转移电子;
(2)已知:①.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),则△H3=2△H1-△H2;
(3)①a.逆反应速率先增大后减小,可能是增大生成物浓度;
b.H2的转化率增大,平衡一定正向移动;
c.反应物的体积百分含量减小,可能是增大生成物浓度等;
d.容器中的$\frac{n(C{O}_{2})}{n({H}_{2})}$值变小,可能是减小二氧化碳的物质的量;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,根据平均反应速率v(CH3OCH3)=$\frac{△c}{△t}$;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,越弱越水解判断;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}$=$\frac{c({H}^{+})c(O{H}^{-})}{K(N{H}_{3}•{H}_{2}O){K}_{1}}$进行计算;
(5)燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式.
解答 解:(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4,
故答案为:Fe3O4;
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为1mol×3×($\frac{8}{3}$-2)=2mol,
故答案为:2mol;
(2)已知:①.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),△H3=2△H1-△H2=2×(-53.7kJ•mol-1)-23.4kJ•mol-1=-130.8kJ•mol-1,
故答案为:-130.8;
(3)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故a错误;
b.H2的转化率增大,平衡一定正向移动,故b正确;
c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,故c错误;
d.容器中的$\frac{n(C{O}_{2})}{n({H}_{2})}$变小,可能是减小二氧化碳物质的量,平衡逆向移动,故d错误,
故答案为:b;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,所以平均反应速率v(CH3OCH3)=$\frac{\frac{1.8mol}{2L}}{5min}$=0.18mol•L-1•min-1 ;
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性;在NH4HCO3溶液中,c(NH${\;}_{4}^{+}$)>c(HCO${\;}_{3}^{-}$ ),反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}$=$\frac{c({H}^{+})c(O{H}^{-})}{K(N{H}_{3}•{H}_{2}O){K}_{1}}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}×4×1{0}^{-7}}$=1.25×10-3;
故答案为:>; 1.25×10-3;
(5)燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:H2-2e-+CO32-═CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+.
点评 本题考查化学平衡计算与影响因素、盖斯定律的应用、对图象分析提取信息能力、原电池和电解池的工作原理及图象的分析等,较好的考查学生对知识的迁移应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 软水是不含Ca2+、Mg2+的水 | |
| B. | 石灰-纯碱法中石灰是指CaCO3 | |
| C. | 石灰-纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度 | |
| D. | 离子交换剂不能再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C═O(CO2) | C═O(COS) | C═S | H-S | H-O |
| E(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V (逆)增大,V(正)减小,平衡逆向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com