
| A. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 10℃ | |
| B. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 10℃ | |
| C. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 30℃ | |
| D. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 30℃ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子与被还原的Cl原子的个数比为1:5 | |
| C. | 氧化剂与还原剂的物质的量的比为1:2 | |
| D. | 每生成1mol的NaClO3转移6mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量H2O反应,电子转移1.204×1023 NA个 | |
| B. | 16 g O2和O3的混合气体中,含O原子 NA个 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 标准状况下,2.24 L水中含有0.1 NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编 号 | ① | ② | ③ | ④ |
| 组成A的物质的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+I2(g)?2HI△H>0 | B. | N2+3H2?2NH3△H<0 | ||
| C. | 2SO3(g)?2SO2+O2△H>0 | D. | 4NH3+5O2(g)?4NO+6H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4、C3H4 | B. | C2H4、C3H8、C2H6 | C. | C2H2、C2H4、C3H6 | D. | C2H2、C2H6、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
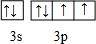 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com