
【题目】顺—1,2—二甲基环丙烷和反—1,2—二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列有关说法正确的是( )
A.某温度时,该反应的平衡常数可表示为K=![]()
B.正、逆反应速率常数改变,平衡常数也一定会随之改变
C.若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能
D.催化剂可以改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆)
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丙烯苯和异丙苯是重要的化工原料,二者存在如图转化关系:

下列说法正确的是
A. 异丙烯苯分子中所有碳原子一定共平面
B. 异丙烯苯和乙苯是同系物
C. 异丙苯与足量氢气完全加成所得产物的一氯代物有6种
D. 0.05mol异丙苯完全燃烧消耗氧气13.44L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造海绵的主要成分是聚氨酯,合成方法如下:

下列说法不正确的是( )
A.M的分子式为C15H10N2O2
B.合成聚氨酯的反应属于缩聚反应
C.聚氨酯在一定条件下可发生水解反应
D.聚氨酯和蛋白质分子中均含有![]() 结构
结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某刚性密闭容器中,充入2molCO和1molNO2,在一定条件下发生反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
A.N2的平衡浓度为0.5mol·L-1
B.2min内NO2的平均反应速率为0.25mol·L-1·min-1
C.反应任意时刻CO和NO2的转化率均相等
D.平衡后再向容器中充入2molCO和1molNO2,再次平衡后,CO的转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法(联合制碱法)工艺流程可用图表示。
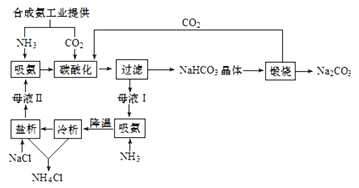
下列有关说法正确的是( )
A.合成氨工业提供的CO2来自焦炭燃烧
B.母液Ⅰ“吸氨”可抑制NH4+水解
C.CO2、NH3和H2O都得到循环利用
D.“冷析”和“盐析”降低了NH4Cl溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
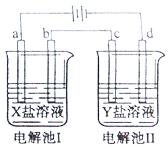
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
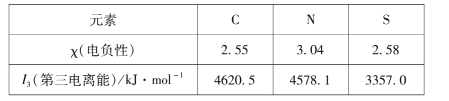
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
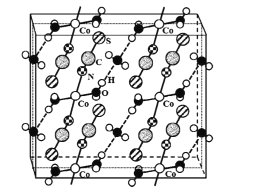
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应ⅠFe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应ⅡFe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;
FeO(s)+H2(g) ΔH2,平衡常数为K2;
在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①由表中判断,反应Ⅰ为中ΔH1______ (填“<”或“=”或“>”) 0。
②反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
③能判断CO2(g)+H2(g) ![]() CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
E.容器内的气体密度不变 F.混合气体的平均摩尔质量不变。
(2)在不同温度和压强下合成氨,起始时投入氮气和氢气的物质的量分别为1mol、3mol。平衡时混合物中氨的体积分数与温度的关系如图。
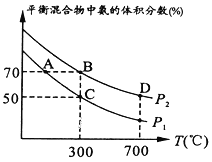
①P1_______P2 (填“>”“=” “<”或“不确定”,)。
②C点H2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com