
【题目】下列有关化学反应的叙述正确的是( )
A.AlCl3溶液和过量氨水生成Al(OH)3B.Mg在CO2中燃烧生成MgCO3
C.Fe(OH)3溶于氢碘酸生成FeI3D.SiO2与H2O反应生成H2SiO3
科目:高中化学 来源: 题型:
【题目】用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)26H2O的流程如图1: 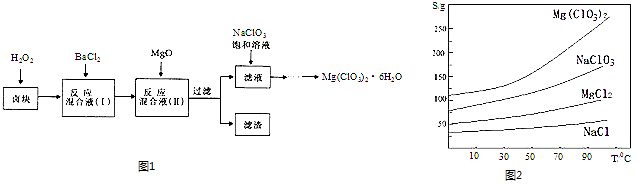
已知:①卤块主要成分为MgCl26H2O,含有MgSO4、FeCl2等杂质.
②四种化合物的溶解度(S)随温度(T)
变化曲线如图2所示.回答下列问题:
(1)过滤时主要的玻璃仪器有 .
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是 .
(3)加速卤块在H2O2溶液中溶解的措施有:(写出一条即可)
(4)加入MgO的作用是; 滤渣的主要成分为 .
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3=Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)26H2O的实验步骤依次为①;②趁热过滤;③;④过滤、洗涤、干燥.
(6)产品中Mg(ClO3)26H2O含量的测定: 步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.l000molL﹣1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00mL.
①请写出步骤2中发生反应的离子方程式(还原产物为Cl﹣)
②产品中Mg(ClO3)26H2O的质量分数为 . (计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的值)( ) 
A.反应前气体的总体积为0.448L
B.装置中氢元素的总质量为0.04g
C.生成物中含有0.01NA个分子
D.生成物完全溶于水后所得溶液含有0.01 NA个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有非常重要的应用.
(1)工业上常用氨气和醋酸二氨和铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO﹣简写为Ac﹣).反应方程式为:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3CO]Ac ①请写出基态Cu原子的电子排布式 .
②氨水溶液中各元素原子的电负性从大到小排列顺序为 .
③醋酸分子中的两个碳原子,甲基(﹣CH3)碳和羧基(﹣COOH)碳的杂化方式分别是 .
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 .
a.离子键 b.配位键 c.σ键 d.π键
(2)如图为一个金属铜的晶胞,请完成以下各题. ①铜原子采取的这种堆积方式的空间利用率为 . (填数值)
②此晶胞立方体的边长为acm,Cu的相对原子质量为64.若阿伏伽德罗常数为NA , 则金属铜的晶体密度ρ为g/cm3 . (用a、NA表示).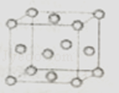
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列进行的各反应中,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是
A.2NaBr+Cl2=2NaCl+Br2 B.2AgOH=Ag2O+H2O
C.2Na+2H2O=2NaOH+H2↑ D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com