

分析 炼锌厂废渣(含ZnO、FeO、CuO)加入硫酸酸浸,ZnO、FeO、CuO与硫酸反应生成硫酸锌、硫酸亚铁以及硫酸铜,过滤得到滤液中加入空气、氢氧化钠溶液和漂白粉,其中漂白粉的作用是氧化亚铁离子为铁离子,氢氧化钠是中和加入过量的酸,调节溶液PH使铁离子全部沉淀,过滤得到滤液中主要是硫酸锌、硫酸铜溶液,加入锌粉,与硫酸铜反应得到铜单质,过滤得到滤液为硫酸锌,第三次操作X后,得到成品的步骤为蒸发浓缩,冷却结晶,过滤洗涤,加热脱水得到硫酸锌,
(1)提高浸出速率可以搅拌、适当升温、将废渣碾细成粉末可加快反应速率等措施;
(2)用氢氧化钠溶液可以除去过量硫酸,使铁离子全部沉淀;
(3)漂白粉中的次氯酸根离子具有强氧化性,在酸性溶液中氧化亚铁离子为铁离子,通入空气是为了加快氧化的反应速率;
(4)分析可知操作X为分离固体和溶液的操作是过滤操作;
(5)第三次操作X后,从溶液中得到成品的步骤为通过蒸发浓缩、冷却结晶、过滤洗涤、干燥受热失水得到硫酸锌;
(6)检验含氯废水中是否存在Cl-、ClO-的实验方案是利用所给试剂中的硝酸银溶液会和氯离子生成白色沉淀氯化银,据此设计检验氯离子,利用氯废水中加入稀硫酸会有淡黄绿色氯气生成,证明含两种离子,溶液中滴入品红溶液会褪色,实验证明含有次氯酸根离子;
解答 解:炼锌厂废渣(含ZnO、FeO、CuO)加入硫酸酸浸,ZnO、FeO、CuO与硫酸反应生成硫酸锌、硫酸亚铁以及硫酸铜,过滤得到滤液中加入空气、氢氧化钠溶液和漂白粉,其中漂白粉的作用是氧化亚铁离子为铁离子,氢氧化钠是中和加入过量的酸,调节溶液PH使铁离子全部沉淀,过滤得到滤液中主要是硫酸锌、硫酸铜溶液,加入锌粉,与硫酸铜反应得到铜单质,过滤得到滤液为硫酸锌,第三次操作X后,得到成品的步骤为蒸发浓缩,冷却结晶,过滤洗涤,加热脱水得到硫酸锌,
(1)提高浸出速率可以搅拌、适当升温、将废渣碾细成粉末可加快反应速率等措施,
故答案为:搅拌、适当升温、将废渣碾细成粉末;
(2)氧化、中和时,需要用NaOH溶液调节pH为4.5~5.0,原因是除去过量硫酸,使铁离子全部沉淀,
故答案为:除去过量硫酸,使铁离子全部沉淀;
(3)漂白粉中的次氯酸根离子具有强氧化性,在酸性溶液中氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,通入空气是为了加快氧化的反应速率,
故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,加快氧化反应速率;
(4)分析可知操作X为分离固体和溶液的操作是过滤操作,
故答案为:过滤;
(5)第三次操作X后,从溶液中得到成品的步骤为通过蒸发浓缩、冷却结晶、过滤洗涤、干燥受热失水得到硫酸锌,
故答案为:蒸发浓缩、冷却结晶;
(6)检验含氯废水中是否存在Cl-、ClO-的实验方案是利用所给试剂中的硝酸银溶液会和氯离子生成白色沉淀氯化银,据此设计检验氯离子,溶液中滴入品红溶液会褪色,实验证明含有次氯酸根离子,具体操作是:取少量废水于试管中,加入硝酸银溶液,有白色沉淀生成说明废液中含氯离子,若无白色沉淀生成,则说明无氯离子存在,上层清液中加入品红溶液,若无变红色现象,则不含次氯酸根离子,若加入品红溶液后变红色,说明含次氯酸根离子,即加入硝酸银溶液生成白色沉淀,上层清液中滴入品红溶液变红色证明废液中含Cl-、ClO-两种离子,若加入硝酸银溶液生成无白色沉淀,上层清液中滴入品红溶液变红色证明废液中含次氯酸根离子,若加入硝酸银溶液生成有白色沉淀,上层清液中滴入品红溶液无变红色现象,说明废液中含氯离子,
故答案为:取少量废水于试管中,加入硝酸银溶液,有白色沉淀生成说明废液中含氯离子,若无白色沉淀生成,则说明无氯离子存在,上层清液中加入品红溶液,若无变红色现象,则不含次氯酸根离子,若加入品红溶液后变红色,说明含次氯酸根离子,即加入硝酸银溶液生成白色沉淀,上层清液中滴入品红溶液变红色证明废液中含Cl-、ClO-两种离子,若加入硝酸银溶液生成无白色沉淀,上层清液中滴入品红溶液变红色证明废液中含次氯酸根离子,若加入硝酸银溶液生成有白色沉淀,上层清液中滴入品红溶液无变红色现象,说明废液中含氯离子;
点评 本题考查了物质的分离提纯实验过程分析判断,离子检验实验设计,注意离子性质的熟练掌握,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
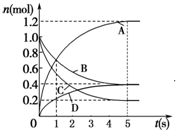 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2 D?3B+4C | |
| B. | 反应进行到1 s时,v(A)=v(B) | |
| C. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| D. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| C. | PM2.5主要来自于煤和石油等化石燃料的燃烧 | |
| D. | 汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的△H>O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇能发生消去反应,而乙烷不能发生消去反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生硝化反应 | |
| D. | 乙烷在光照条件下能发生取代反应,而乙炔不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 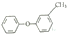 的同分异构体中,有醇、酚、酯类物质 的同分异构体中,有醇、酚、酯类物质 | |
| B. | 1mol 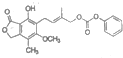 最多能与含5.0molNaOH的水溶液完全反应 最多能与含5.0molNaOH的水溶液完全反应 | |
| C. | 纯净物C4H8的氢种类最多为3种 | |
| D. | 化学式为C8H8的有机物,一定能和溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当X是活泼的金属时,它一定是强碱 | |
| B. | X是得电子能力很强的非金属元素,X-0-H一定为酸 | |
| C. | X-0-H的水溶液不能导电 | |
| D. | X-0-H不可能是直线形的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、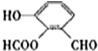 ..
..查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:实验题
实验室需要450 mL0.2 mol·L-1的硫酸,现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制。请回答下列问题:
(1)所需的仪器除了玻璃棒、烧杯、量筒,还可能用到的玻璃仪器是:___________
(2)配制溶液时,一般可以分为以下几个步骤:①量取 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为__________________.
(3)经计算,需浓硫酸的体积为 ;
(4)在容量瓶的使用方法中,下列操作不正确的是(填编号)________。
A.往容量瓶中转移溶液时应用玻璃棒引流 |
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 |
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线 |
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接沿玻璃棒引流至容量瓶中,缓慢加入蒸馏水到标线 |
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com