
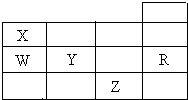
 如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )
如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )| A. | XZ3是平面正三角形分子 | |
| B. | 钠与X形成的化合物Na3X和NaX3都是含有共价键的离子晶体 | |
| C. | W与Y元素的最高价氧化物对应的水化物酸性前者弱于后者 | |
| D. | X的氢化物比W的氢化物稳定,但沸点前者比后者低 |
分析 图为元素周期表前四周期的一部分,由元素的位置可知,X为N,W为P,Y为S,R为Ar,Z为Br,
A.XZ3是NBr3,立体构型为三角锥形;
B.Na3N中无共价键;
C.同周期元素从左到右,非金属性逐渐增强,非金属性越强最高价含氧酸的酸性越强;
D.同主族自上而下,非金属性减弱,非金属性越强,氢化物越稳定;氢键使沸点升高.
解答 解:图为元素周期表前四周期的一部分,由元素的位置可知,X为N,W为P,Y为S,R为Ar,Z为Br,则:
A.XZ3是NBr3,NBr3中N形成3个δ键,孤对电子数为$\frac{1}{2}$(5-3×1)=1,为sp3杂化,含有一个孤对电子,立体构型为三角锥形,故A错误;
B.Na3N中无共价键,故B错误;
C.同周期元素从左到右,非金属性逐渐增强,所以非金属性Y>W,则Y元素最高价氧化物对应水化物的酸性比W元素的最高价氧化物对应水化物的酸性强,故C正确;
D.同主族自上而下,非金属性减弱,所以非金属性X>W,非金属性越强,氢化物越稳定,所以氢化物的稳定性X>W;X的氢化物是氨气,氨气分子间存在氢键,使沸点相对较高,即X的氢化物比W的氢化物沸点高,故D错误;
故选:C.
点评 本题考查位置结构性质的关系及应用,利用元素的位置推断出元素是解答的关键,熟悉空间构型、化学键的判断、非金属性比较的方法及氢键的性质即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | AgCl溶于氨水:AgCl+2NH3•H2O=[Ag(NH3)2]++Clˉ+2H2O | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO3 2- | |
| D. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-=Ag++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 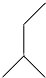 (2-乙基丙烷) (2-乙基丙烷) | B. | CH3CH2CH2CH2OH(1-丁醇) | ||
| C. |  (间二甲苯) (间二甲苯) | D. | CH3C(CH3)=CH2(2-甲基-2-丙烯) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
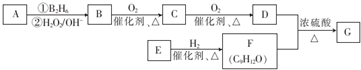
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应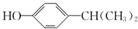
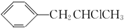 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):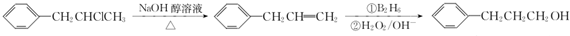 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
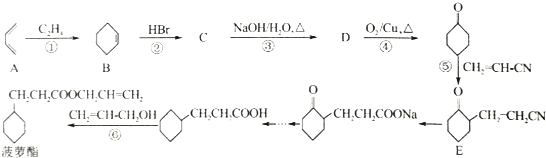
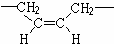 ,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.
,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.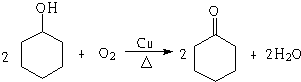 .
.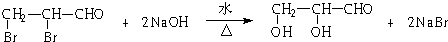 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com