
分析 n(Zn)=$\frac{13.0g}{65g/mol}$=0.2mol,n( H2SO4)=1.5mol/L×0.2L=0.3mol,二者以1:1反应,所以硫酸有剩余,剩余n( H2SO4)=0.3mol-0.2mol=0.1mol,溶液中溶质为硫酸锌和硫酸,根据Zn原子守恒计算锌离子浓度;根据H原子守恒计算氢离子浓度.
解答 解:n(Zn)=$\frac{13.0g}{65g/mol}$=0.2mol,n( H2SO4)=1.5mol/L×0.2L=0.3mol,二者以1:1反应,所以硫酸有剩余,剩余n( H2SO4)=0.3mol-0.2mol=0.1mol,溶液中溶质为ZnSO4和H2SO4,根据Zn原子守恒得n(Zn 2+ )=n(Zn)=0.2mol,c(Zn 2+ )=$\frac{0.2mol}{0.2L}$=0.1mol/L;根据H原子守恒得n(H+)=2n( H2SO4)=0.1mol×2=0.2mol,所以c(H+)=$\frac{0.2mol}{0.2L}$=0.1mol/L,
故答案为:ZnSO4和H2SO4;c(Zn 2+ )=0.1mol/L、c(H+)=0.1mol/L.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,明确溶液中溶质及其物质的量是解本题关键,注意过量计算,题目难度不大.


科目:高中化学 来源: 题型:实验题
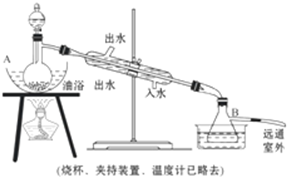
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中滴入盐酸:OH-+H+=H2O | |
| B. | 石灰乳与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 向沸水中逐滴滴加FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据纯净物的元素组成,将纯净物分为单质和化合物 | |
| B. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| C. | 根据能水溶液能否电离出氢离子,来判断化合物是否是酸 | |
| D. | 根据是否含金属元素,来判断氧化物是否是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
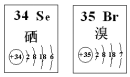
| A. | 原子半径:Br>Se | B. | 还原性:Se2-<Br- | ||
| C. | 在Se2Br2分子中只含有极性键 | D. | SeO2 既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z |
| A. | Z元素氢化物的水溶液一定是强酸 | |
| B. | 四种元素原子形成的简单离子,半径最小的一定是Y | |
| C. | 四种元素最高价氧化物对应的水化物酸性最强的一定是Y | |
| D. | 四种元素对应的简单氢化物稳定性最强的一定是Y |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列各组中的离子 ,能在溶液中大量共存的是
,能在溶液中大量共存的是
A.K+ 、H+ 、SO42- 、OH- B.Na+ 、Ca2+ 、CO32- 、NO3-
C.Na+ 、H+ 、Cl- 、CO32- D.Na+ 、Cu2+ 、Cl- 、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com