
液氨是一种良好的储氢物质。
已知:①2NH3(g)  N2 (g)+3H2(g) ΔH = +92.4 kJ·mol-1
N2 (g)+3H2(g) ΔH = +92.4 kJ·mol-1
②液氨中2NH3(l)  NH2- +NH4+
NH2- +NH4+
(1)氨气自发分解的反应条件是 (填“低温”或“高温”)。
(2)图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。反应的活化能最大的是 (填催化剂的化学式)。
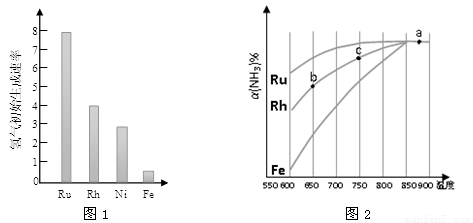
(3)其他条件相同,反应①在不同催化剂作用下反应相同时间后,氨气的转化率随反应温度的变化如图2所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点氨气的转化率高于b点,原因是 。
③请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线。
④假设Ru催化下,温度为750 ℃时,氨气的初始浓度为c0,平衡转化率为40%,则该温度下此反应的平衡常数K = 。
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
A.X2YZ3 B.X2YZ2 C.XYZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:填空题
(14分)煤粉中的氮元素在使用过程中的转化关系如下图所示:
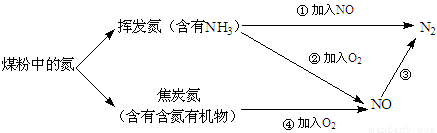
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶(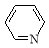 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g)===2NO(g) ΔH = a kJ·mol-1
N2(g) + 3H2(g)===2NH3(g) ΔH = b kJ·mol-1
2H2(g) + O2(g)===2H2O(l) ΔH = c kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.淀粉和纤维素水解的最终产物都是葡萄糖
B.可以用NaOH溶液除去乙酸乙酯中的乙醇
C.天然油脂的主要成分是高级脂肪酸
D.CH≡CH和CH2=CHCH=CH2互为同系物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
80 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的碳酸中:c(H+)=3.0 molL-1
B.饱和乙酸钠溶液中:c(Na+)= c(CH3COO-)
C.pH为2的盐酸中:c(H+)=c(Cl﹣)+c(OH﹣)
D.pH=13的烧碱溶液中:c(OH-)=1.0×10-1 molL-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:填空题
〔化学—选修2:化学与技术〕(15分)Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。
(2)吸收塔中的原料B可以选用 (填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。
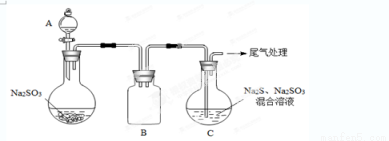
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
②C中制备Na2S2O3发生的连续反应有:Na2S+H2O+SO2 = Na2SO3 +H2S、 和Na2SO3+S  Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三二模理综化学试卷(解析版) 题型:选择题
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
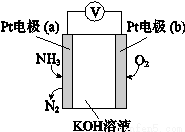
A.O2在电极b上发生还原反应
B.溶液中OH—向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为:2NH3-6e—+6OH—=N2+6H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:实验题
(本题14分)
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。

请回答下列问题:
(1).氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2).吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3).碱性条件下反应①的离子方程式为____________________________________。
(4).过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4→K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5).K2FeO4 在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(6).可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O→CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+→Cr2O72-+H2O
③Cr2O72- +6Fe2++14H+→2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。(答案用小数表示,保留3位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com