

分析 (1)①由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应;升高温度平衡逆向移动,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯;正反应是放热反应,随温度的升高,该反应的化学平衡常数减小;
(2)太阳能电池中光能转化为电能,电解强酸性的二氧化碳水溶液得到乙烯,电能转化为化学能;二氧化碳在连接电源a极的电极上得电子发生还原反应生成乙烯,a为电源负极,b为电源的正极;正极的电极反应式为:3CO2+18H++18e-=C3H6+6H2O;
(3)根据图知,发生反应:过程2中发生反应的化学方程式为6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C;过程1中发生反应的化学方程式为2Fe3O4 $\frac{\underline{\;>2300\;}}{\;}$6FeO+O2↑,每消耗2molFe3O4转移电子的物质的量为4mol,所以每消耗1molFe3O4转移电子的物质的量为2mol;
(4)一定量CO2溶于NaOH溶于中恰好得到25mL0.1000mol/LNa2CO3溶液,在常温下用0.1000mol/L的盐酸对其进行滴定,c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成等物质的量的NaHCO3和NaCl,所以离子浓度大小为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式.
解答 解:(1)由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,故△H<0,根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应;a曲线随着温3CO2+18H++18e-=C3H6+6H2O度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,所以c曲线代表乙烯,正反应是放热反应,随温度的升高,该反应的化学平衡常数减小,
故答案为:<;乙烯;减小;
(2)太阳能电池中光能转化为电能,电解强酸性的二氧化碳水溶液得到乙烯,电能转化为化学能;二氧化碳在连接电源a极的电极上得电子发生还原反应生成乙烯,a为电源负极,b为电源的正极;正极的电极反应式为:3CO2+18H++18e-=C3H6+6H2O,
故答案为:a;3CO2+18H++18e-=C3H6+6H2O;
(3)根据图知,发生反应:过程2中发生反应的化学方程式为6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C;过程1中发生反应的化学方程式为2Fe3O4 $\frac{\underline{\;>2300\;}}{\;}$6FeO+O2↑,每消耗2molFe3O4转移电子的物质的量为4mol,所以每消耗1molFe3O4转移电子的物质的量为2mol,
故答案为:6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C;2mol;
(4)一定量CO2溶于NaOH溶于中恰好得到25mL0.1000mol/LNa2CO3溶液,在常温下用0.1000mol/L的盐酸对其进行滴定,c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成等物质的量的NaHCO3和NaCl,所以离子浓度大小为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)①2NH3(g)+CO2(g)=NH2CO2 NH4(s)△H=+l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=-116.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
由热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol.
点评 本题考查化学平衡图象、原电池和电解池原理、氧化还原反应有关计算、离子浓度大小比较和盖斯定律的应用等,(4)中关键是判断各点溶液中溶质,难度较大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
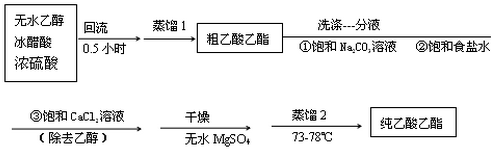
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由A和B两种元素形成的化合物BA5中含共价键 | |
| B. | 含C或E元素的某些物质具有杀菌消毒的作用,其原理相同 | |
| C. | 原子半径:D>C>B,离子半径B>C>D | |
| D. | 由A、C、E三种元素形成的某种化合物AEC,其结构式A-E-C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg和Al都可以用电解法冶炼得到 | |
| B. | Mg和Fe在一定条件下与水反应都生成H2 和对应的碱 | |
| C. | Fe和Cu常温下放入浓硝酸中发生的现象相同 | |
| D. | Na2O和Na2O2与CO2反应产物也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
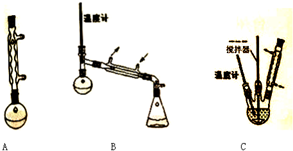
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第1次 | 0.00 | 1.98 |
| 第2次 | 1.98 | 4.00 |
| 第3次 | 4.00 | 5.80 |
| 第4次 | 5.80 | 7.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 反应开始时,甲中石墨电极上Fe3+被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com