
| A、室温时,氨水与氯化铵的 pH=7 的混合溶液中:c(Cl-)>c(NH4+) |
| B、室温时,pH=2 的一元酸和 pH=12 的一元强碱等体积混合:c(OH-)=c(H+) |
| C、0.1 mol?L-1 的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D、0.1 mol?L-1 的硫化钠溶液中:c(OH )=c(H+)+c(HS-)+c(H2S) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、HCOOH+H2O═HCOO-+H3O+ |
| B、CO2+H2O═HCO3-+H+ |
| C、CO32-+H2O═HCO3-+OH- |
| D、HS-═S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| HBr |
| NaOH口口 |
| 口 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.5 | B、8 | C、8.5 | D、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
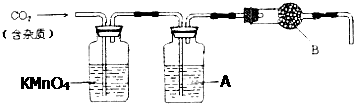
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B、1 mol AlCl3在熔融时离子总数为0.4NA |
| C、常温常压下,等质量的SO2、S2含有相同的分子数 |
| D、125 g CuSO4?5H2O晶体中含有0.5NA个Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
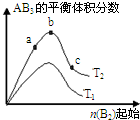 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )| A、正反应一定是放热反应 |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时A2的转化率大小为:b>a>c |
| D、b点时,平衡体系中A、B原子数之比接近3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com