
| A. | 银氨溶液可以用于区分葡萄糖和麦芽糖 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 对苯二酚和 互为同系物 互为同系物 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
分析 A.葡萄糖和麦芽糖均含-CHO;
B.-OH越多,沸点越高;
C.酚-OH的数目不同;
D.苯环、碳碳双键均为平面结构,且直接相连.
解答 解:A.葡萄糖和麦芽糖均含-CHO,均发生银镜反应,银氨溶液不能鉴别,故A错误;
B.-OH越多,沸点越高,则乙醇、乙二醇、丙三醇的沸点依次升高,故B正确;
C.酚-OH的数目不同,则二者不是同系物,故C错误;
D.苯环、碳碳双键均为平面结构,且直接相连,则所有C可能共面,但甲基为四面体结构,不可能所有原子共面,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物鉴别、同系物判断等为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.02 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入0.2molB和0.2molC,重新达到平衡前v(正)>v(逆) | |
| D. | 在200℃时,向容器中充入2mol A 和1mol B,达到平衡时,A 的体积分数大于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{催化剂.△}^{RCH_{2}C-O-CCH_{2}R}$
$→_{催化剂.△}^{RCH_{2}C-O-CCH_{2}R}$ (R=CCOOH(R=-CH3或-H)
(R=CCOOH(R=-CH3或-H) $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用烧碱溶液消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH═NaNO2+H2O | |
| B. | 制硝酸铜:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | |
| C. | 制甲基丙烯酸甲酯(即有机玻璃): | |
| D. | 制硫酸铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低 $\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
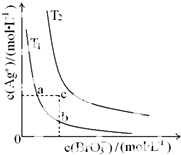
| A. | T1>T2 | |
| B. | 加入AgNO3固体,可使a点变到c点 | |
| C. | a点和b点的Ksp相等 | |
| D. | c点时,在T1、T2两个温度下均有固体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com