
| A. | 单质--铝 石墨 氮气 | |
| B. | 混合物--空气 粗盐 牛奶 | |
| C. | 碱--烧碱 纯碱 熟石灰 | |
| D. | 氧化物--氧化铜 二氧化锰 二氧化碳 |
分析 单质是由同种元素组成的纯净物.混合物是由不同种物质组成的物质.氧化物是由两种元素组成并且一种元素是氧元素的化合物.电离时生成的阴离子全部是氢氧根离子的化合物是碱.由金属离子和酸根离子组成的化合物是盐.
解答 解:A、铝、石墨、氮气都是由同种元素组成的纯净物,属于单质,故A正确;
B、空气、粗盐、牛奶都是由多种物质组成的物质,属于混合物,故B正确;
C、纯碱是由金属离子和酸根离子组成的化合物,属于盐而不属于碱,故C错误;
D、氧化铜、二氧化锰、二氧化碳都是由两种元素组成并且一种元素是氧元素的化合物,属于氧化物,故D正确;
故选C.
点评 本题主要考查了物质的分类方面的内容,理解纯净物、混合物、单质、氧化物、酸碱盐的概念并能运用之,此题属于基础题型.


科目:高中化学 来源: 题型:解答题
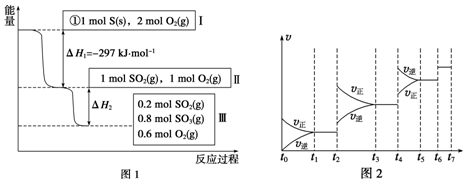
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属银的表面生成一层黑色物质 | |
| B. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离成Na+ 和Cl- | |
| B. | 蔗糖在水溶液里或熔融状态时均不导电,所以它不是电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
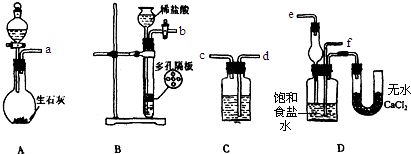
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向5mL 0.4mol•L-1 NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | |
| B. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 | |
| C. | 用某已知浓度的HCl 滴定未知浓度的NaOH,滴定前尖嘴有气泡滴定终点气泡消失,则测定所得NaOH的浓度偏低 | |
| D. | 向氯水中滴加AgNO3、稀HNO3溶液,若产生白色沉淀,则说明氯水中含有氯离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com