
【题目】如图所示,b、d是运用有机合成制备的具有立体结构的有机物,p、m是广泛存在于动植物体内萜类化合物,下列说法正确的是

A. b与d互为同分异构体,p与m互为同分异构体
B. b、d、p中,只有p的所有碳原子在同一个平面上
C. d、p、m均可与酸性高锰酸钾溶液反应
D. b的二氯代物有三种,d与H2加成后的产物的一氯代物有四种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图)。下列叙述错误的是

A. 雾和霾的分散剂相同 B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂 D. 雾霾的形成与过度施用氮肥、燃料燃烧 有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车、工厂等污染源排入大气的碳氢化合物和氮氧化物等一次污染物,在紫外光作用下发生光化学反应生成了二次污染物。光化学烟雾是一次污染物和二次污染物的混合物。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是_______(用文字说明)。
②NO的来源是______(用方程式说明)。
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有______种。
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:

①下列说法正确的是_____(填标号)。
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式______(注:每消耗1molO3,同时生成1molO2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有KOH和Ca(OH)2的混合溶液,c(OH﹣)=0.1 molL﹣1。取此溶液500 mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示。图中(V1)为112 mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )

A. 560、672 B. 1008、1120 C. 2240、2352 D. 392、504
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与铁相似,金属锡能与盐酸反应生成氯化亚锡(SnCl2),氯化亚锡又能被氯化铁氧化为氯化锡(SnCl4)。则下列有关粒子氧化性和还原性强弱的比较中,正确的是
A.氧化性:Sn4+<Sn2+B.氧化性:Fe3+<Sn4+
C.还原性:Fe2+<Sn2+D.还原性:Fe<Sn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界__________。
(2)表中最活泼的金属与最活泼的非金属形成的物质是__________________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________________________________________________________________,这两种化合物中所含的化学键有________(填字母)。
A 极性共价键 B 非极性共价键 C 离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为__________(填离子符号)。
(5)d、m对应的离子还原性由强到弱顺序为___________________________________(填离子符号)。
(6)d、e、m的气态氢化物中,最不稳定的是________________________(填分子式)。
(7)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3是灰黑色、有光泽的固体,主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。以废镍料为原料提取Ni2O3的工艺流程如图所示。

请回答下列问题:
(1)镍的某种化合物NiOOH,其中Ni的化合价为___________。
(2)加入双氧水“氧化”的离子方程式为____________________;滤渣A的主要成分是________________(填化学式)。
(3)步骤①中为了控制“氧化”效率,最佳物质的量之比NaOH/NaClO =________。
(4)步骤②电解法制取Ni2O3,用NaOH调酸溶后溶液的pH至7.5,加入适量Na2SO4后以惰性电极电解。电解过程中产生的Cl2有约40%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。加入Na2SO4的作用__________________________;当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量约为____________。
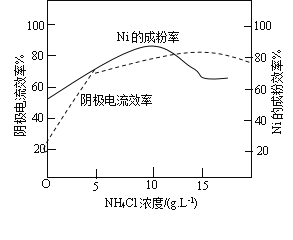
(5)工业上,镍作阳极,电解0.1molL-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉的影响如图所示。
① 为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为__________gL-1。
② 当NH4Cl浓度大于15gL-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C. 10 s后,该反应停止进行
D. 反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com