
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是X |
| B、氧化物对应水化物的酸性Z一定强于Y |
| C、形成的单核阴离子还原性Y强于X |
| D、Z元素单质在化学反应中只表现氧化性,它在水溶液中有漂白性 |


科目:高中化学 来源: 题型:
A、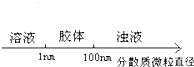 分散系的分类 |
B、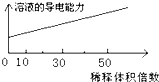 醋酸稀释 |
C、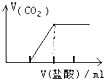 向Na2CO3溶液中逐滴滴入盐酸 |
D、 向AlCl3溶液中滴加过量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
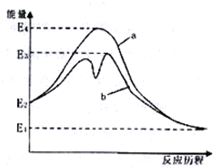 如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,
如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,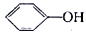 Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )
Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )| A、图说明了催化剂参与化学反应,并降低了活化能 |
| B、图中该反应没有催化剂参与时活化能为E2-E1 |
| C、将少量CO2通入NaClO溶液中,发生如下反应NaClO+CO2+H2O═HClO+NaHCO 3 |
D、相同浓度的NaClO溶液和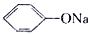 溶液,前者pH小 溶液,前者pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2.8H2O与NH4Cl的反应 |
| C、灼热的炭与CO2的反应 |
| D、甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温 | B、加压 |
| C、加水稀释 | D、滴加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 化学键 | H-Cl | O=O | Cl=Cl | H-O |
| 键能/kJ.mol-1 | 431 | 498 | 243 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18.0L |
| B、27.0L |
| C、31.4L |
| D、33.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应是氧化还原反应 |
| B、MnO2发生还原反应 |
| C、HCl是还原剂 |
| D、若生成7.1 g Cl2,则转移0.1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
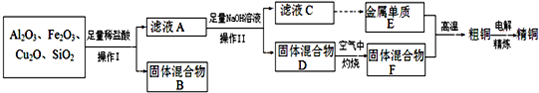
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com