
| A.①② | B.①③ | C.①④ | D.③④ |
科目:高中化学 来源:不详 题型:单选题
| A.① | B.③⑥ | C.②④⑥ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。(用“离子符号”表示)
W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。(用“离子符号”表示)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B、C、D四种短周期元素,它们的核电荷数依次增大;A元素原子核外只有一个电子;C元素的焰色反应呈黄色;B元素原子L层电子数是K层电子数的3倍;D原子核中的质子数比C多6个。
B、C、D四种短周期元素,它们的核电荷数依次增大;A元素原子核外只有一个电子;C元素的焰色反应呈黄色;B元素原子L层电子数是K层电子数的3倍;D原子核中的质子数比C多6个。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标况下22.4L水中含有的水分子数和1g H2中所含的氢气分子数 |
| B.Na2O2晶体中的阳离子和阴离子 |
| C.C原子的电子层数与最外层电子数 |
D.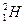 原子中的中子和质子 原子中的中子和质子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X的离子半径比Y的大 |
| B.X原子的最外层电子数比Y的多 |
| C.X的原子半径比Y的大 |
| D.X元素的最高正价比Y的小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
| B.碳和硅都是IVA族元素,Si和SiO2都是原子晶体; 则C和CO2也是原子晶体 |
| C.卤族元素最高价氧化物的水化物酸性:HClO4>HBrO4>HIO4;则也有酸性:盐酸>氢溴酸>氢碘酸 |
| D.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com