
| A. | 实验室由乙醇生成乙烯,温度控制在170℃而不是140℃ | |
| B. | 高锰酸钾溶液与H2C2O4反应时加入MnSO4 | |
| C. | 铜与浓硫酸反应时将铜丝绕成螺旋状 | |
| D. | 实验室制备乙炔时用饱和食盐水代替水 |
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 加聚反应 | D. | 酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol/LNaCl溶液含有NA个Na+ | |
| B. | 任意条件下,16gO3所含的原子数为NA | |
| C. | 1molFe与足量稀HNO3反应,转移3NA个电子 | |
| D. | 标准状况下,22.4LSO3所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 元素的相关信息 |
| A | 存在多种核素,其中一种核素没有中子 |
| B | 形成化合物种类最多的元素 |
| C | 其最高价氧化物的水化物能与其气态氢化物反应生成盐 |
| D | 最外层电子数是内层电子数3倍的元素 |
| E | 单质或其化合物在火焰灼烧时,火焰呈黄色 |
| F | 最高正价与负价的代数和为4 |
| G | 对应的最高价氧化物的水化物的酸性最强 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
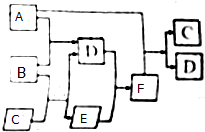 有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:填空题
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L-1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2 溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为_________________________.
(2)硫酸的物质的量浓度: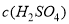 =____________________________.
=____________________________.
(3)该HCl气体在标准状况下的体积为_____________mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为____________g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol/L,加入等体积0.3 mol/L的BaCl2溶液恰好使SO42-完全沉淀,则原混合溶液中Na+的浓度为
A.0.3 m ol/L B.0.45mol/L C.0.6mol/L D.0.15mol/L
ol/L B.0.45mol/L C.0.6mol/L D.0.15mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:实验题
氯化钠样品中含有少量的杂质Na2SO4,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称。写出有关反应的化学方程式:
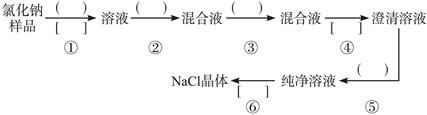
(1)操作①、②、③、⑤中所需加入试剂分别为________、_________、_________、________。
(2)操作①、④、⑥的操作名称分别为_________、_________、_________。
(3)写出有关的化学方程式:
第②步:_____________________________。
第⑤步:_____________________________。
(4)操作④所用到的玻璃仪器有_____________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:填空题
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36, Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。
回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y Z(填“大于”或“小于”),化合物HZY分子的空间构型为 。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是 ,该氢化物在水中的溶解性如何?主要原因是什么?
(3)元素Y 3个原子形成的单质分子与元素X、Y形成的一种离子互为等电子体,这种离子的化学式是 。
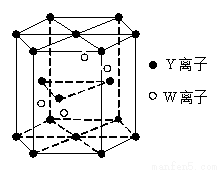
(4)基态W原子的电子排布式是 ,元素Y和W的一种化合物的晶体结构如右图所示,该晶体的化学式为 。(W处于晶体内部,Y分别处于晶胞面心、顶点、和内部)
(5)金属原子 (选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com