
下图是N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)的平衡移动图,影响该平衡的原因是:
2NH3(g)(正反应为放热反应)的平衡移动图,影响该平衡的原因是:
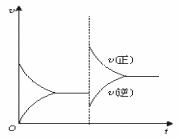
A、升温,同时加压
B、减压,同时降温
C、增大反应物浓度,并使用催化剂
D、增大反应物浓度,同时减小生成物浓度
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化

(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 = - 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 = - 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 = - 2599.2 kJ/mol,则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 = - 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 = - 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 = - 2599.2 kJ/mol,则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为_________
查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭州市高级中学高三上学期第三次月考化学试卷 题型:填空题
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 =" -" 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 =" -" 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 =" -" 2599.2 kJ/mol,则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为_________
查看答案和解析>>
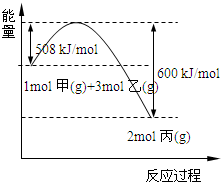
科目:高中化学 来源:2011-2012学年河北省高三下学期二调考试理综试卷(解析版) 题型:填空题
(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为 。
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式 。

(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l) △H= -483.6 kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H=+67.8 kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H=-92.0 kJ/mol
请计算NH3 (g)的燃烧热 。
|
温度[来源:学§科§网] |
平衡浓度/ (mol L-1)[来源:学*科*网Z*X*X*K][来源:学_科_网Z_X_X_K] |
|
|
c(NH3) |
c(CO2) |
|
|
T1 |
0.1 |
|
|
T2 |
|
0.1 |
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s) 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
|
成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Br- |
64 |
|
Mg2+ |
1272 |
|
|
 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是 。
(2)在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程
式是 。

(3)淡水的出口为 (填“a”、“b”或“c”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com