
| A. |  检验溶液中是否含有K+ | B. |  除去水中的乙醇 | ||
| C. |  分离乙酸和乙酸钠 | D. |  用MnO2和浓盐酸制备Cl2 |
分析 A.K元素焰色反应必须透过蓝色钴玻璃观察;
B.互溶的液体采用蒸馏方法分离;
C.互溶的物质采用蒸馏方法分离;
D.氯气密度大于空气,应该采用向上排空气法收集,且尾气处理装置要防止倒吸.
解答 解:A.K元素焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,故A错误;
B.互溶的液体采用蒸馏方法分离,水和乙醇互溶,应该采用蒸馏方法分离,故B错误;
C.互溶的物质采用蒸馏方法分离,乙酸和乙酸钠都易溶于水,应该采用蒸馏方法分离,故C正确;
D.氯气密度大于空气,应该采用向上排空气法收集,且尾气处理装置要防止倒吸,所以导气管应该采用“长进短出”原则,尾气处理时要用倒置的漏斗来防止倒吸,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、焰色反应、气体制取和收集等知识点,明确实验原理及物质性质是解本题关键,注意基本操作规范性和评价性,知道物质分离方法与物质性质的关系,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | ① | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲乙丙丁 | B. | 丁乙丙甲 | C. | 丙乙丁甲 | D. | 乙丁丙甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和热时,用环形铜质搅拌棒搅拌溶液,使测得的温度更准确 | |
| B. | 利用烧杯、玻璃棒、量筒、容量瓶就可以配制2mol•L-1的硫酸溶液 | |
| C. | 用稀NaOH溶液除去溴苯中混有的Br2 | |
| D. | 用酒精萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
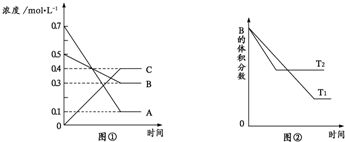
| A. | 该反应的化学方程式是A+3B═2C | |
| B. | 该反应的正反应为放热反应 | |
| C. | 定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 | |
| D. | 压强增大,则该反应的正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
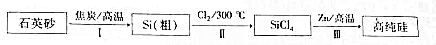
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com