
����Ŀ��������Ӧ���������칤���������Ѿ��������ҹ��Ŵ���¯��ʯ����Ҫ�ɷ�ZnCO3����úұп���գ�п����Ҫ��;������п�Ͻ����Ϊ���������ı����㡣�ش�����������
��1��Znԭ�ӻ�̬��������Ų�ʽΪ_____________________________��
��2������п���ڰ�ˮ�γ�[Zn(NH3)4]SO4��Һ��
����SO42-��Ϊ�ȵ�����������ӻ�ѧʽΪ________________��д��һ����
���������ȶ���ǿ���(PH3)��ԭ����____________________________��
��3����ͭ����ͭ��п����ɵĺϽ�Ԫ��ͭ��п�ĵ�һ�����ֱܷ�ΪICu=746 kJ��mol-1��IZn=906 kJ��mol-1��ICu< IZn��ԭ����___________________��
��4�������ݸ�Ŀ���м���¯��ʯ����Ҫ�ɷ�ZnCO3����ֹѪ����������������Ŀ������Zn��C��O�縺���ɴ���С��˳����_________________��ZnCO3�������ӵ����幹����_____________________��
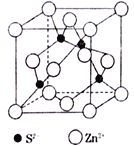
��5��ZnS��ӫ���塢�����ϡ�Ϳ�ϡ����ϵ���ҵ��Ӧ�ù㷺������ZnS�����ṹ��ͼ��ʾ��ÿ��Znԭ����Χ�����Znԭ����ĿΪ________________�������߳�Ϊapm�������ӵ�������ֵΪNA����ZnS������ܶ�Ϊ __________g��cm-3���г�����ʽ��������
���𰸡� 1s22s22p63s23p63d104s2��[Ar]3d104s2 PO43-(��ClO4-) ��Ԫ�صķǽ�����ǿ����Ԫ�� пʧȥ����ȫ������4s2���ӣ�ͭʧȥ����4s1���� O>C>Zn ƽ�������� 12 97��4/(a��10-10)3NA
����������1��Zn��30��Ԫ�أ���ԭ�ӻ�̬��������Ų�ʽΪ1s22s22p63s23p63d104s2��[Ar]3d104s2��
��2������SO42-��Ϊ�ȵ��������������PO43-(��ClO4-) ���ڰ������ȶ���ǿ���(PH3)��ԭ���ǵ�Ԫ�صķǽ�����ǿ����Ԫ����
��3��Ԫ��ͭ��п�ĵ�һ�����ֱܷ�ΪICu=746 kJ��mol-1��IZn=906 kJ��mol-1��ICu< IZn��ԭ����пʧȥ����ȫ������4s2���ӣ�ͭʧȥ����4s1������
��4��ͨ���ǽ�����Խǿ��Ԫ����縺��Խ��Zn��C��O�縺���ɴ���С��˳����O>C>Zn��ZnCO3��������CO32-������ԭ��C���ӻ���ʽ��sp2��C��3��O�γ�����������CO32-�����幹����ƽ����������
��5��������ZnS�����ṹʾ��ͼ��֪���þ�������4��Znԭ�Ӻ�4��Sԭ����ÿ��Znԭ����Χ�����Znԭ����λ�ھ����Ķ���������ϵ�Znԭ�ӣ�ÿ���������ڽ���3���������������ÿ��Znԭ����Χ�����Znԭ����ĿΪ![]() 12�������߳�Ϊapm�������ӵ�������ֵΪNA����NA������������������ֱ���
12�������߳�Ϊapm�������ӵ�������ֵΪNA����NA������������������ֱ���![]() ��NA (a��10-10)3 cm3�����ԣ�ZnS������ܶ�Ϊ 97��4/(a��10-10)3NAg��cm-3��
��NA (a��10-10)3 cm3�����ԣ�ZnS������ܶ�Ϊ 97��4/(a��10-10)3NAg��cm-3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���-������صĹ���ԭ����ͼ��ʾ�����ж�缫����ѡ�������ʱ�� �õ�ر��ֳ����õ�ѭ�����ܡ���ط�ӦΪ�� 2Li��O2��Li2O2�� ����˵������
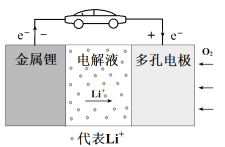
A. �õ�صĵ��Һ������ε��л���Һ
B. ��ع���ʱ�����·������ 0.01 mol �������������ϼ��� 0.07g
C. ��ع���ʱ��������Ӧ���ܾ����������̣� Li+��O2��e����LiO2 Li+��LiO2��e����Li2O2
D. ��س��ʱ��Խ��������� Li2O2Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ�����ȷ���ǣ� ��
�� | �� | �� | ���������� | ���������� | |
A | Na2CO3 | H2SO4 | BaCO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����1.0Lw mol��L-lCH3COOH��Һ��0.1molNaOH�����ϣ���ַ�Ӧ��Ȼ������Һ�м���CH3COOH��CH3COONa����������������¶ȱ仯����������ҺpH�ı仯��ͼ��ʾ������������ȷ����
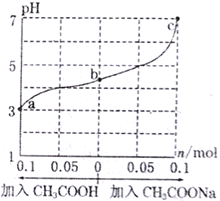
A. a��b��c��Ӧ�Ļ��Һ�У�ˮ�ĵ���̶��ɴ�С��˳����c>a>b
B. b����Һ��c(Na+)>c(CH3COO-)
C. ����CH3COOH������![]() ����
����
D. 25��ʱ��CH3COOH�ĵ���ƽ�ⳣ��Ka=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�������Ҫ��Ⱦ��֮һ�����γ����ꡢ�����������еĵ���������Ҫ��Դ��ȼ�ϵ�ȼ�ա�
��1����֪��N2(g)+O2(g)![]() 2NO(g)��H=-180.5kJ��mol-1��N��N����941kJ��mol-1��O��O����499kJ��mol-1����NO��N��O���ļ���Ϊ___________ kJ��mol-1��
2NO(g)��H=-180.5kJ��mol-1��N��N����941kJ��mol-1��O��O����499kJ��mol-1����NO��N��O���ļ���Ϊ___________ kJ��mol-1��
��2��T��ʱ����1L�����ܱ������г���1molN2O3��1molO2��������Ӧ��N2O3(g)+O2(g)![]() N2O5(g) ��H=-62kJ��mol-1����ƽ��ʱN2O3��N2O5�����������ȣ���T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____________��
N2O5(g) ��H=-62kJ��mol-1����ƽ��ʱN2O3��N2O5�����������ȣ���T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____________��
��3���û���N2O5�������������ɽ�NO��O2��ԭ��N2��H2O�����μӷ�Ӧ��NH3��NO�����ʵ�����ȣ���÷�Ӧ�Ļ�ѧ����ʽΪ___________����֪�÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵΪlg K=5.08+![]() �����÷�Ӧ��t���´ﵽƽ�⣬�����¶�ʱ��ƽ��___________����������������ƶ����淴Ӧ���ʽ�____________���������С�����䡱����
�����÷�Ӧ��t���´ﵽƽ�⣬�����¶�ʱ��ƽ��___________����������������ƶ����淴Ӧ���ʽ�____________���������С�����䡱����
��4��ͼI����ʳ��ˮ�����Һ��������ѵ���һ��ԭ��ͼ��NO ��������������������������ΪNO3-��β��������������Һ���պ�����������С������ܶȺ���ҺpH�������ѵ���Ӱ����ͼII��
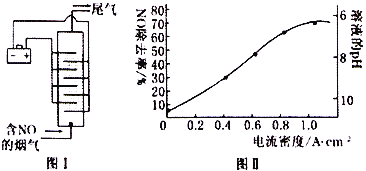
���������β���У�һ�����е����嵥����___________���ѧʽ����
����Һ��pH��NO��ȥ����Ӱ���ԭ����___________��
�����缫�����Ϊ10cm2��ʵ��������NO���������Ϊ1.5%������Ϊ0.070 L��s-1���������������ɱ�״���������������������屻����������õ����ܶ�Ϊ1.0A��cm-2��ʵ����NO��ȥ��Ϊ___________�������ڳ���Ϊ96500C��mol-1)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��Һ�������һ�����͵���ɫ�������ܵ�أ������ܷ�ӦΪ��V3++VO2++H2O ![]() VO2++2H++V2+ �� ����˵����ȷ���ǣ�������
VO2++2H++V2+ �� ����˵����ȷ���ǣ�������
A.�ŵ�ʱ������ӦΪ��VO2++2H++e��=VO2++H2O
B.�ŵ�ʱÿת��2mol����ʱ������1mol������
C.�������е������������������������������������������Һ��������
D.�ŵ�����У�H+����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش����⣺
��1����֪�ڳ��³�ѹ�£� ��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=��1275.6kJmol��1
��H2O��l���TH2O��g����H=+44.0kJmol��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ ��
��2���£�H2NNH2����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol��ѧ�������������kJ����N��NΪ942��O=OΪ500��N��NΪ154�������1mol N��H�������������kJ���� �� 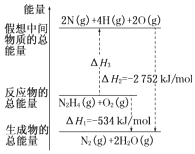
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭпԭ��أ���ͼ������ʱ������˵����ȷ���ǣ������� �ٵ������������Zn�����ݩ�Cu�����ţ���Zn�缫����������Cu�缫���������أ��������е�K+����CuSO4��Һ���ܽ�пƬ��������ͭ��Һ�����Ļ�ѧ��Ӧ��õ�ط�Ӧ��ͬΪ��Zn+Cu2+�TZn2++Cu����Zn�缫ʧ���ӷ�����ԭ��Ӧ��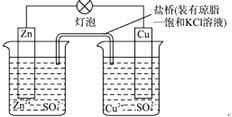
A.�٢ڢ�
B.�ڢܢ�
C.�ڢۢ�
D.�ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�м��Ҿ�������ԭ���װ�á��밴Ҫ�����
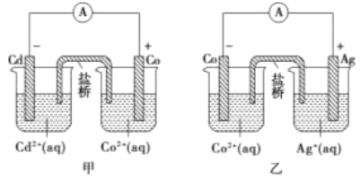
(1)����Co�缫�����ķ�Ӧ����ʽΪ_____________________________________��
(2)���ձ�������(�����Ϊ���б���KNO3��Һ����֬)��������__________��ʹ���ձ�����Һ���ֵ����ԡ�
(3)�жϷ�Ӧ2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)�ܷ��Է����в���������_________________________��
(4)��ʼʱ���ҵ�������ձ�����100��Һ����Co2+��Ag+Ũ�Ⱦ�Ϊ4mol/L������1.204��1022������ͨ�����·ʱ�����ձ���Һ��Co2+��Ag+Ũ�Ȳ�Ϊ__________(������Һ������仯)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com