
| A、第四周期第ⅤA族 |
| B、第五周期第ⅢA族 |
| C、第五周期第ⅠA族 |
| D、第四周期第ⅢA族 |
科目:高中化学 来源: 题型:
| ||
| 充电 |
2- 3 |
| A、充电时阴极发生氧化反应 |
| B、放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O |
| C、通入0.25 mol氧气并完全反应后,有0.5 mol e-转移 |
| D、放电一段时间后,通入氧气的电极附近溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱溶液去油污 |
| B、配制氯化铁溶液时加入少量的盐酸 |
| C、NaHCO3与Al2(SO4)3混合作泡沫灭火剂 |
| D、铁在潮湿的环境下生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
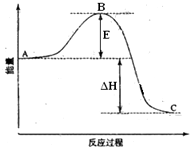 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0 |
| B、a+b<c+d |
| C、温度升高,平衡常数增大,平衡向逆反应方向移动 |
| D、增加A的量,平衡向正反应方向移动,A的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、2:3 |
| C、3:2 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO(g)的燃烧热:△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol |
| B、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C、己知2C(s)+2O2(g)=2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b |
| D、已知C (石墨,s)=C (金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
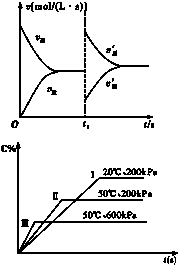
| A、升高温度,同时增大压强 |
| B、降低温度,同时减小压强 |
| C、增大反应物的浓度,同时使用适宜的催化剂 |
| D、增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com