
| A、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D、测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
| n |
| V |
| n |
| V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
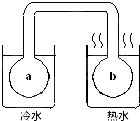 如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )
如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )| A、NO2(g) |
| B、Br2(g) |
| C、NO(g) |
| D、N2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、σ键能单独形成,而π键一定不能单独形成 |
| B、σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C、HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D、气体单质中一定存在σ键,可能存在π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| A | 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B | 原子核外M层电子数是N层电子数的4倍 |
| C | 是使用最为广泛的合金的主要成分 |
| D | 原子各内层电子均已饱和,最外层电子数为1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com