
 CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K=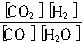 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z |
| 温度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:022
已知可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)(正反应为放热反应),在850℃时,其化学平衡常数K=1.
CO2(g)+H2(g)(正反应为放热反应),在850℃时,其化学平衡常数K=1.
(1)若升高温度到950℃时,达到平衡时K________1(填“大于”、“小于”或“等于”).
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%和b%,则a________b(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:038
已知可逆反应:CO+H2O![]() CO2+H2,达到平衡时,K=[CO2][H2]/[CO][H2O],K是常数,只与温度有关,与浓度无关.
CO2+H2,达到平衡时,K=[CO2][H2]/[CO][H2O],K是常数,只与温度有关,与浓度无关.
(1)830 K时,若起始时,CO为2 mol·L-1,H2O为3 mol·L-1,平衡时CO的转化率为60%,计算水蒸气的转化率及K值.
(2)830 K,若只将起始时H2O改为6 mol·L-1,计算水蒸气的转化率.
(3)若830 K时,CO起始浓度为a mol·L-1,H2O起始浓度为b mol·L-1,H2浓度为c mol·L-1:
计算:①a、b、c的关系式
②当a=b时,a=________c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com