
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
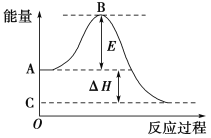
(1)图中A点表示:___________, B点表示:__________,E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
【答案】 反应物的总能量 正反应的活化能 无 -198
【解析】(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;(2)根据参加反应SO2的物质的量之比等于对应的ΔH之比。
详解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
因此,本题正确答案是:反应物总能量、正反应的活化能;无;
(2)因1 mol SO2氧化为1 mol SO3的ΔH=-99 kJ·mol-1,所以2mol SO2氧化为2mol SO3的ΔH=-198 kJ·mol-1,
则2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-198 kJ·mol-1,因此,本题正确答案是: -198。
2SO3(g) ΔH=-198 kJ·mol-1,因此,本题正确答案是: -198。


科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获取氢气:Fe+2H2O+2OH-![]() FeO42-+3H2↑,工作原理如图(a)所示,电解质溶液为氢氧化钠溶液,若氢氧化钠溶液浓度过高,铁电极区会产生红褐色色物质。C(Na2FeO4)随初始C(NaOH)的变化如图(b)所示。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法不正确的是
FeO42-+3H2↑,工作原理如图(a)所示,电解质溶液为氢氧化钠溶液,若氢氧化钠溶液浓度过高,铁电极区会产生红褐色色物质。C(Na2FeO4)随初始C(NaOH)的变化如图(b)所示。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法不正确的是
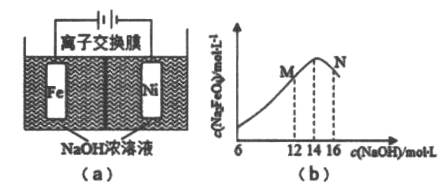
A. 电解一段时间后,阳极室c(OH-)降低
B. 电路中经过0.2mol电子时,阴极室生成H2 2.24L(标准状况)
C. M点C(Na2FeO4)低于最高值的原因是铁电极上有Fe(OH)3生成
D. 阳极的电极反应:Fe一6e-+8OH-===FeO42-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞物质组成的叙述,正确的是
A. 在人体活细胞中氧原子的数目最多
B. 脂肪细胞含量最多的化合物是脂肪
C. 每种细胞所含的有机物最多的都是蛋白质
D. 组成蛋白质的元素一定有C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在某酸雨区的潮湿空气中发生电化学腐蚀,其负极上的反应是
A.O2+2H2O+4e-=4OH-B.2H++2e-=H2↑
C.Fe-2e-=Fe2+D.4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】铁、钻、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)基态钴原子的价电子排布式为________,铁、钴、镍的基态原子核外未成对电子数最少的是_____________
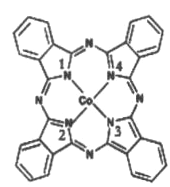
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是__________ (填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____(用相应的元素符号表示);碳原子的杂化轨道类型为_________
(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO) x晶体属于_______ (填晶体类型),若配合物Fe(CO) x的中心原子价电子数与配体提供电子数之和为18,则x=_________
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO ______ FeO(填“>”“<”或“=”),原因是___________________________。
(5)NiAs的晶胞结构如图所示:
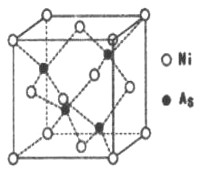
①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为pg.cm-1,则该晶胞中最近的离子之间的距离为_____cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.单位时间内消耗1 molNH2COONH4 ,同时生成2mol NH3
F.密闭容器中混合气体的平均摩尔质量不变 G.容器内NH3与CO2的浓度之比为2∶1 H.6个N—H键断裂的同时,有2个C=O键形成
(2)根据表中数据,计算25.0 ℃时的分解平衡常数______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g);△H1=+156.6kJmol﹣1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g);△H2=+32.4kJmol﹣1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式;放电时,CO32﹣移向电池的 (填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com