短周期元素X、Y、Z、W、Q的原子序数依次增大.Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料.请回答:
(1)Y在元素周期表中的位置是______.
(2)W2Z的电子式是______.
(3)W2Z2与X2Z反应的化学方程式是______.
(4)上述元素中有两种非金属元素位于同一主族,能证明它们非金属性强弱的一个反应的化学方程式是______.
(5)在25℃、101kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0kJ,则该反应的热化学方程式是______.
【答案】
分析:短周期元素X、Y、Z、W、Q的原子序数依次增大.Y原子最外层电子数是次外层的2倍,Y有2个电子层,最外层电子数为4,则Y为碳元素;Q的单质是常见的半导体材料,则Q为Si元素;X、W可分别与Z组成常见化合物X
2Z、X
2Z
2、W
2Z、W
2Z
2,则X为氢元素、Z为氧元素、W为Na元素,据此解答.
解答:解:短周期元素X、Y、Z、W、Q的原子序数依次增大.Y原子最外层电子数是次外层的2倍,Y有2个电子层,最外层电子数为4,则Y为碳元素;Q的单质是常见的半导体材料,则Q为Si元素;X、W可分别与Z组成常见化合物X
2Z、X
2Z
2、W
2Z、W
2Z
2,则X为氢元素、Z为氧元素、W为Na元素,
(1)Y为碳元素,碳原子有2个电子层,最外层电子数为4,处于元素周期表中第二周期第ⅣA族,
故答案为:第二周期第ⅣA族;
(2)W
2Z是Na
2O,属于离子化合物,由钠离子与氧离子构成,电子式为
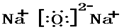
,
故答案为:
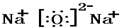
;
(3)Na
2O
2与H
2O反应生成NaOH与O
2,反应方程式为:2Na
2O
2+2H
2O=4NaOH+O
2↑,
故答案为:2Na
2O
2+2H
2O=4NaOH+O
2↑;
(4)上述元素中有两种非金属元素位于同一主族,两种非金属元素为C、Si,方程式CO
2+H
2O+Na
2SiO
3=Na
2CO
3+H
2SiO
3(胶体),能证明碳非金属性更强,
故答案为:CO
2+H
2O+Na
2SiO
3=Na
2CO
3+H
2SiO
3(胶体);
(5)在25℃、101kPa下,SiH
4在氧气中完全燃烧生成SiO
2,反应中每转移1mole
-,参加反应的SiH
4为
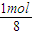
=

mol,故1molSiH
4燃烧放出的热量为190.0kJ×8=1520kJ,故该反应的热化学方程式是SiH
4(g)+2O
2 (g)=SiO
2(s)+2H
2O(l)△H=-1520.0 kJ/mol,
故答案为:SiH
4(g)+2O
2 (g)=SiO
2(s)+2H
2O(l)△H=-1520.0 kJ/mol.
点评:本题考查结构性质位置关系、常用化学用语、元素化合物性质等,难度不大,注意掌握热化学方程式的书写.

 ,
,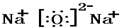 ;
;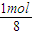 =
= mol,故1molSiH4燃烧放出的热量为190.0kJ×8=1520kJ,故该反应的热化学方程式是SiH4(g)+2O2 (g)=SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol,
mol,故1molSiH4燃烧放出的热量为190.0kJ×8=1520kJ,故该反应的热化学方程式是SiH4(g)+2O2 (g)=SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol,
